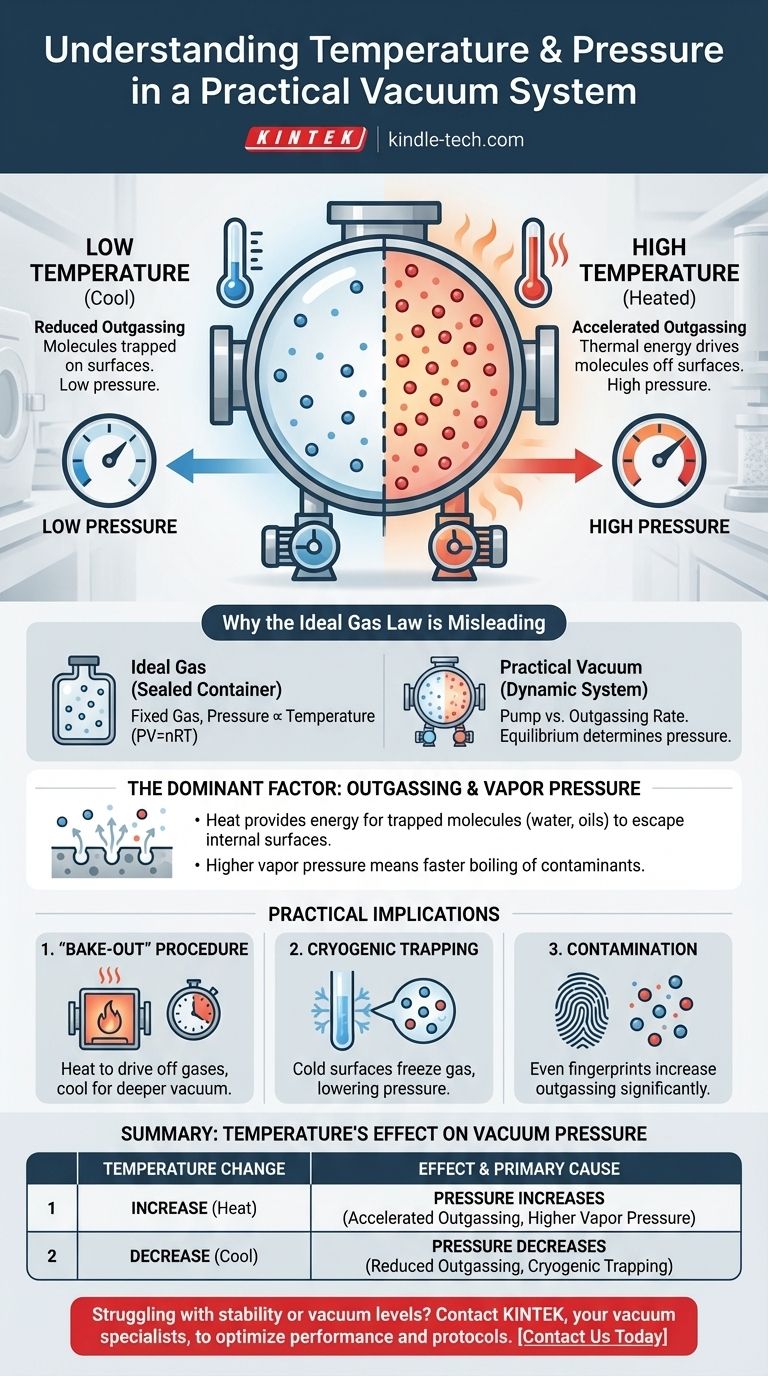
En un sistema de vacío práctico, la relación es directa: aumentar la temperatura del sistema aumentará la presión, degradando así la calidad del vacío. Esto ocurre porque el calor proporciona la energía para que las moléculas atrapadas en las superficies internas de la cámara escapen al espacio de vacío. Este proceso, conocido como desgasificado (outgassing), es la fuente dominante de presión en entornos de alto vacío.
La presión dentro de una cámara de vacío del mundo real no se rige por la Ley de los Gases Ideales, sino por la tasa de desgasificado de sus superficies internas. Las temperaturas más altas aumentan esta tasa, liberando más moléculas de gas y, por lo tanto, aumentando la presión general.

Por qué la Ley de los Gases Ideales es Engañosa Aquí
El Concepto Erróneo de un "Gas Contenido"
La conocida Ley de los Gases Ideales (PV=nRT) describe la relación entre presión, volumen y temperatura para una cantidad fija de gas en un recipiente sellado. En ese escenario, la presión es directamente proporcional a la temperatura.
Sin embargo, una cámara de vacío no es un recipiente sellado con una cantidad fija de gas. Es un sistema dinámico donde una bomba elimina activamente moléculas.
La Realidad: Un Equilibrio Dinámico
La presión en un vacío está determinada por el equilibrio entre la velocidad a la que la bomba elimina moléculas y la velocidad a la que nuevas moléculas ingresan al sistema. La principal fuente de estas nuevas moléculas son las superficies internas de la propia cámara.
El Factor Dominante: Desgasificado y Presión de Vapor
¿Qué es el Desgasificado?
Todos los materiales tienen moléculas de gas adsorbidas (pegadas a la superficie) o absorbidas (atrapadas dentro del material). En un vacío, estas moléculas escaparán gradualmente de las superficies.
Este proceso se denomina desgasificado (outgassing). El principal culpable en la mayoría de los sistemas de vacío es el vapor de agua, pero los aceites, disolventes y gases atrapados durante la fabricación también contribuyen.
Cómo la Temperatura Impulsa el Desgasificado
Calentar las paredes de la cámara de vacío transfiere energía térmica a las moléculas atrapadas. Esta energía aumentada les permite superar las fuerzas que las mantienen adheridas a la superficie, provocando que se liberen al vacío.
Una temperatura más alta significa una tasa de desgasificado significativamente mayor, lo que conduce directamente a una presión más alta.
El Papel de la Presión de Vapor
Para cualquier sustancia condensada, como una gota de agua o una película de aceite dentro de la cámara, existe una presión de vapor. Esta es la presión a la que la sustancia está en equilibrio con su propio gas a una temperatura dada.
A medida que aumenta la temperatura, la presión de vapor de estos contaminantes aumenta exponencialmente. Si la presión de vapor del contaminante excede la presión en la cámara, hervirá rápidamente, provocando un aumento dramático de la presión.
Comprender las Implicaciones Prácticas
El Procedimiento de "Horneado" (Bake-Out)
Los ingenieros explotan esta relación temperatura-presión para lograr el vacío ultra alto (UHV). Un sistema se calienta, a menudo a cientos de grados Celsius, durante muchas horas o días mientras las bombas están funcionando.
Este "horneado" acelera drásticamente el desgasificado, expulsando el agua atrapada y otros contaminantes para que las bombas puedan eliminarlos permanentemente. Una vez que el sistema se enfría, la tasa de desgasificado es mucho menor, lo que permite un vacío mucho más profundo.
El Impacto de la Criogenia
El efecto opuesto también se utiliza. Las superficies extremadamente frías, conocidas como trampas criogénicas o bombas criogénicas, actúan como sumideros para las moléculas de gas.
Cuando una molécula como el agua golpea una superficie muy fría, se congela instantáneamente y su presión de vapor se vuelve insignificante. Esto la elimina efectivamente del vacío, reduciendo drásticamente la presión del sistema.
El Problema de la Contaminación
Este principio resalta por qué la limpieza es primordial en la tecnología de vacío. Una sola huella dactilar contiene aceites y agua que actuarán como una fuente significativa de desgasificado, limitando el vacío final que un sistema puede alcanzar, especialmente cuando se calienta.
Tomar la Decisión Correcta para su Objetivo
Para gestionar eficazmente un sistema de vacío, debe tratar la temperatura como una variable de control principal.
- Si su enfoque principal es lograr el vacío más profundo posible: Debe calentar la cámara en un "horneado" mientras bombea para forzar la salida de los gases atrapados, y luego permitir que se enfríe para alcanzar la presión objetivo.
- Si su enfoque principal es mantener un vacío estable durante un proceso: Debe asegurar un control preciso de la temperatura, ya que incluso pequeñas fluctuaciones térmicas causarán cambios de presión debido a las tasas de desgasificado cambiantes.
- Si su enfoque principal es tratar con sustancias de alta presión de vapor: Es posible que deba utilizar refrigeración criogénica (trampas frías) para capturar vapores y evitar que abrumen sus bombas.
En última instancia, dominar la presión en su sistema de vacío significa dominar la energía térmica de sus superficies.
Tabla Resumen:
| Cambio de Temperatura | Efecto sobre la Presión de Vacío | Causa Principal |
|---|---|---|
| Aumento | La Presión Aumenta | Desgasificado acelerado y mayor presión de vapor de los contaminantes. |
| Disminución | La Presión Disminuye | Tasa de desgasificado reducida; las superficies criogénicas pueden atrapar moléculas. |
¿Tiene problemas con la inestabilidad de la presión o no puede alcanzar el nivel de vacío deseado? La gestión térmica de su sistema es probablemente la clave. KINTEK se especializa en equipos de laboratorio y consumibles para aplicaciones de vacío de precisión. Nuestros expertos pueden ayudarle a seleccionar los componentes adecuados y desarrollar protocolos de horneado, control de temperatura o captura criogénica para garantizar que sus procesos de vacío sean fiables y repetibles. Contacte hoy mismo a nuestros especialistas en vacío para optimizar el rendimiento de su sistema.
Guía Visual
Productos relacionados
- Máquina de prensa hidráulica con calentamiento y placas calientes para prensa en caliente de laboratorio con caja de vacío
- Prensa Térmica Hidráulica Eléctrica Calefactada al Vacío para Laboratorio
- Horno de Tratamiento Térmico al Vacío con Revestimiento de Fibra Cerámica
- Prensa Hidráulica Manual de Alta Temperatura con Placas Calefactoras para Laboratorio
- Horno de Tratamiento Térmico al Vacío de Molibdeno
La gente también pregunta
- ¿Cuáles son las consideraciones para el diseño de sistemas de vacío? Logre un rendimiento óptimo para su laboratorio
- ¿Cuál es el papel de los hornos de alta temperatura en la preparación de sales de cloruro fundido? Dominio de la pureza y la deshidratación
- ¿Cuáles son las aplicaciones del proceso de sinterización? Fabricar piezas complejas con materiales de alto rendimiento
- ¿Qué tipo de llama se utiliza para el recocido? La Llama Correcta para un Alivio Perfecto del Estrés del Vidrio
- ¿Qué papel juega un horno de vacío de alto rendimiento en la reducción del óxido de titanio de fase Magnéli?
- ¿Es fuerte una unión soldada fuerte? Sí, puede ser más fuerte que el metal base
- ¿Qué es la soldadura fuerte a alta temperatura? Consiga uniones metálicas fuertes y limpias para ensamblajes complejos
- ¿Se evapora el metal en el vacío? Descubra el poder de la deposición de película delgada



















