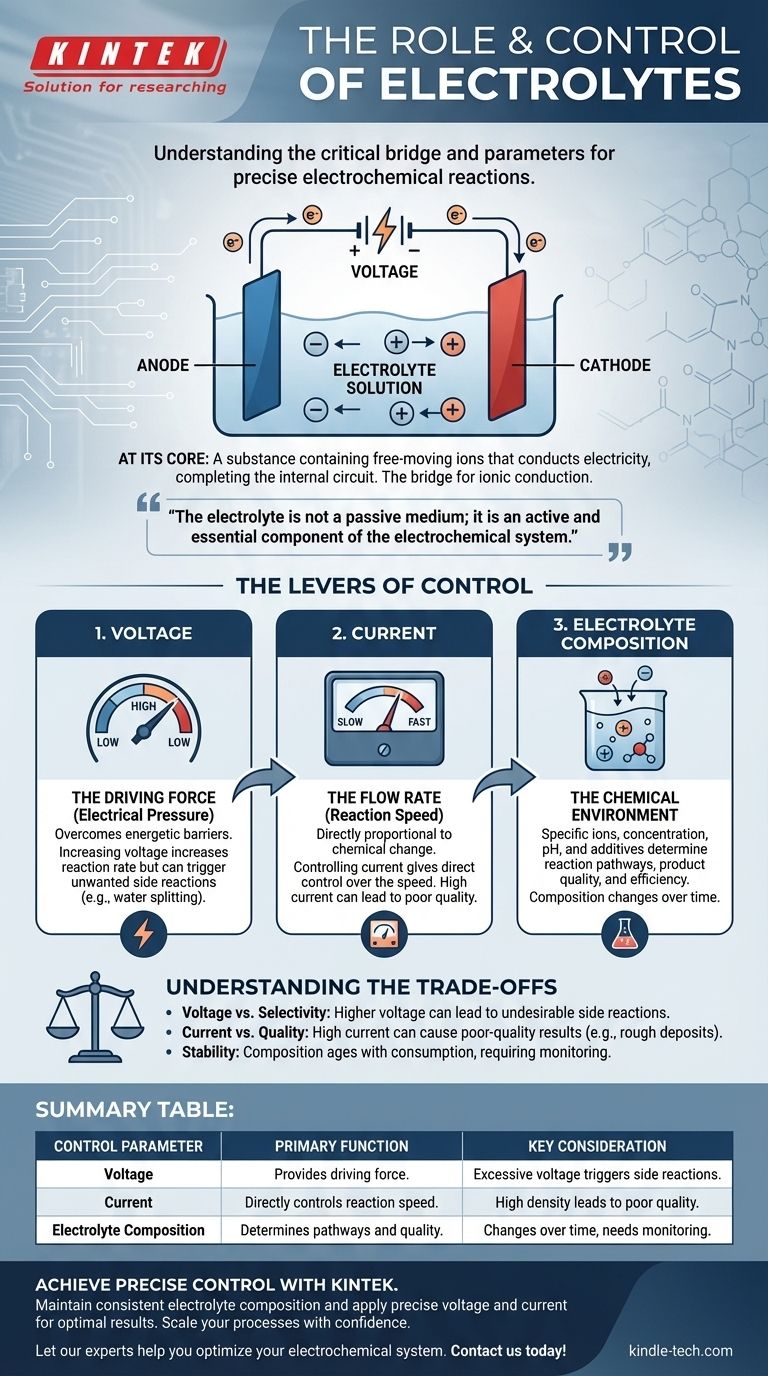
En esencia, un electrolito es una sustancia que contiene iones de movimiento libre y que conduce la electricidad, completando el circuito dentro de una celda electroquímica. Es el puente fundamental que permite que una reacción química sea impulsada por una fuente de energía externa. La reacción en sí se controla con precisión ajustando tres parámetros clave: el voltaje aplicado, la corriente resultante y la composición química del electrolito.
El electrolito no es un medio pasivo; es un componente activo y esencial del sistema electroquímico. Comprender cómo manipular las entradas eléctricas y la química del electrolito es la clave para transformar una reacción de un proceso de fuerza bruta a una operación controlada con precisión.

El papel fundamental del electrolito
Para controlar un sistema, primero debe comprender sus componentes innegociables. En electroquímica, el electrolito es la vía interna que hace posible todo el proceso.
¿Qué es un electrolito?
Un electrolito es típicamente una solución que contiene sales, ácidos o bases disueltos, que se disocian en cationes cargados positivamente y aniones cargados negativamente. Si bien a menudo son una solución acuosa (a base de agua), también pueden basarse en disolventes orgánicos o incluso existir como sales fundidas a altas temperaturas.
La propiedad clave es la presencia de iones móviles. Sin ellos, el circuito interno se rompe y no puede ocurrir ninguna reacción electroquímica.
El puente para la conducción iónica
Una celda electroquímica tiene dos circuitos. El circuito externo es el cableado a través del cual viajan los electrones de un electrodo a otro.
El circuito interno es el electrolito. A medida que los electrones llegan a un electrodo (el cátodo) y salen del otro (el ánodo), los iones deben moverse a través del electrolito para equilibrar la carga. Los cationes se mueven hacia el cátodo y los aniones se mueven hacia el ánodo, completando el circuito eléctrico.
Más que solo un conductor
El electrolito también participa activamente en la reacción. Su composición determina qué especies químicas están disponibles para ser oxidadas o reducidas, cuáles serán los productos de la reacción y qué tan rápido puede proceder la reacción.
Las palancas de control: cómo gestionar la reacción
Controlar una reacción electroquímica significa manipular la velocidad y el resultado de los cambios químicos que ocurren en los electrodos. Esto se logra gestionando las propiedades eléctricas y químicas del sistema.
Control del voltaje (la fuerza impulsora)
El voltaje puede considerarse como la "presión eléctrica" que impulsa la reacción hacia adelante. Se requiere un voltaje mínimo determinado para superar la barrera energética de una reacción específica.
Aumentar el voltaje generalmente aumenta la velocidad de la reacción. Sin embargo, aplicar un voltaje excesivo es un instrumento poco sutil que puede desencadenar reacciones secundarias no deseadas.
Control de la corriente (la velocidad de flujo)
La corriente es la medida de cuántos electrones fluyen a través del circuito por unidad de tiempo. De acuerdo con las leyes de Faraday de la electrólisis, la cantidad de cambio químico es directamente proporcional a la cantidad de carga pasada.
Por lo tanto, controlar la corriente le da un control directo sobre la velocidad de la reacción. Una corriente constante (control galvánico) asegura que la reacción proceda a un ritmo constante y predecible.
Ajuste de la composición del electrolito (el entorno químico)
Este es el nivel de control más matizado. Los iones específicos, su concentración, el disolvente y cualquier aditivo cambian fundamentalmente el entorno de la reacción.
Los factores clave incluyen la concentración (que afecta la conductividad y la disponibilidad de iones), el pH (que puede dictar qué reacciones son posibles en el agua) y la presencia de aditivos especializados que pueden inhibir la corrosión, dar un acabado brillante a un recubrimiento o modificar el resultado de otra manera.
Comprender las compensaciones
El control preciso requiere conciencia de las limitaciones y consecuencias de cada ajuste. Empujar un parámetro a su extremo a menudo compromete a otro.
El problema del voltaje frente a la selectividad
Si bien un voltaje más alto aumenta la velocidad, también puede proporcionar suficiente energía para iniciar reacciones indeseables. Por ejemplo, en una solución acuosa, un voltaje excesivo puede comenzar a dividir el agua en hidrógeno y oxígeno, consumiendo energía y reduciendo la eficiencia de su objetivo principal.
Densidad de corriente y calidad
Forzar una corriente muy alta (y por lo tanto una velocidad de reacción alta) puede provocar resultados de mala calidad. En la galvanoplastia, una corriente demasiado alta puede hacer que los iones se agoten cerca de la superficie del electrodo, lo que resulta en un depósito áspero, poroso o quemado. La calidad a menudo requiere paciencia y una menor densidad de corriente.
Estabilidad y vida útil del electrolito
El electrolito no es estático. Su composición cambia durante la reacción a medida que se consumen iones y se introducen contaminantes. Los disolventes pueden evaporarse y los aditivos pueden agotarse. Este "envejecimiento" del electrolito es una fuente principal de inconsistencia en los procesos industriales de larga duración y requiere supervisión y mantenimiento.
Tomar la decisión correcta para su objetivo
Su estrategia de control depende completamente de lo que quiera lograr. Utilice estos principios para guiar su enfoque.
- Si su enfoque principal es maximizar la velocidad de reacción: Utilice una corriente más alta y asegúrese de que la concentración del electrolito sea lo suficientemente alta para soportar esta velocidad sin un agotamiento significativo de iones cerca de los electrodos.
- Si su enfoque principal es lograr una alta precisión o calidad: Utilice una densidad de corriente más baja y cuidadosamente controlada o aplique un voltaje específico (control potencioestático) para asegurar que la reacción proceda sin problemas y de manera selectiva.
- Si su enfoque principal es solucionar problemas de un proceso inconsistente: Comience por analizar el electrolito. Su composición, concentración y posible contaminación son las fuentes más comunes de variabilidad del proceso.
Dominar estos principios transforma un proceso electroquímico de una caja negra a un sistema sintonizable con precisión.
Tabla de resumen:
| Parámetro de control | Función principal | Consideración clave |
|---|---|---|
| Voltaje | Proporciona la fuerza impulsora para la reacción. | Un voltaje excesivo puede desencadenar reacciones secundarias no deseadas. |
| Corriente | Controla directamente la velocidad de la reacción. | Una alta densidad de corriente puede provocar resultados de mala calidad. |
| Composición del electrolito | Determina las vías de reacción y la calidad del producto. | La composición cambia con el tiempo, lo que requiere supervisión. |
¿Listo para lograr un control preciso sobre sus procesos electroquímicos?
En KINTEK, nos especializamos en proporcionar el equipo de laboratorio y los consumibles de alta calidad que necesita para dominar sus reacciones. Ya sea que esté desarrollando nuevos materiales, realizando galvanoplastia o llevando a cabo investigaciones, nuestras soluciones le ayudan a:
- Mantener una composición electrolítica constante para obtener resultados fiables.
- Aplicar un control preciso de voltaje y corriente para una selectividad y calidad óptimas.
- Escalar sus procesos desde la mesa de laboratorio hasta la producción con confianza.
Permita que nuestros expertos le ayuden a optimizar su sistema electroquímico. Contáctenos hoy para analizar su aplicación y desafíos específicos.
Guía Visual
Productos relacionados
- Celda de gas de difusión electrolítica electroquímica Celda de reacción de flujo de líquido
- Celda electrolítica electroquímica óptica de doble capa tipo H con baño de agua
- Celda electroquímica electrolítica de cuarzo para experimentos electroquímicos
- Celda electrolítica de PTFE Celda electroquímica sellada y no sellada resistente a la corrosión
- Celda Electrolítica Electroquímica para Evaluación de Recubrimientos
La gente también pregunta
- ¿Cuáles son las ventajas de usar un tanque de deposición de PTFE para EPD? Logre una precisión de recubrimiento inigualable en acero inoxidable
- ¿Qué funciones desempeñan las celdas electrolíticas en la división del agua PEC? Optimice su investigación fotoquímica
- ¿Cuáles son las funciones principales de una celda electrolítica de alto rendimiento en el proceso eCO2R? Optimice los resultados de su laboratorio
- ¿Cuál es el propósito de la estructura de doble capa en la celda electrolítica tipo H? Lograr un control térmico preciso
- ¿Qué papel juega un reactor electroquímico de dos electrodos en el crecimiento de TiO2? Logre nanostructuras ordenadas hoy mismo



















