Criterios de diseño de las células electrolíticas
Volumen de la célula electrolítica
El volumen de una célula electrolítica desempeña un papel fundamental a la hora de determinar la eficacia y la precisión de los procesos electroquímicos. El volumen óptimo de la célula depende del mantenimiento de una relación adecuada entre el electrodo de trabajo y el volumen de la solución. Esta relación no es estática, sino que varía significativamente en función del tipo específico de medición o ensayo que se realice.
Por ejemplo, en las mediciones analíticas de alta precisión, a menudo se prefiere un volumen de celda más pequeño con una mayor relación electrodo-solución. Esta configuración minimiza el grosor de la capa de difusión, mejorando así la sensibilidad y la precisión de las lecturas. Por el contrario, en aplicaciones industriales en las que se produce metal a gran escala, puede ser necesario un volumen de celda mayor con una relación electrodo-solución menor para adaptarse al mayor rendimiento y a las exigencias operativas.
| Tipo de medición | Volumen de celda preferido | Relación electrodo-solución |
|---|---|---|
| Análisis de alta precisión | Pequeño | Alta (por ejemplo, 1:10) |
| Producción industrial de metales | Grande | Baja (por ejemplo, 1:100) |
Comprender y optimizar esta relación es crucial para lograr los resultados deseados en diversas aplicaciones electroquímicas.
Material de la célula electrolítica
A la hora de seleccionar los materiales para las celdas electrolíticas, destacan dos opciones principales: el vidrio y el politetrafluoroetileno (PTFE). Cada material tiene sus propias ventajas y limitaciones, que deben considerarse cuidadosamente en función de la aplicación específica y las condiciones ambientales.
El PTFE, en particular, es famoso por su excepcional estabilidad, sobre todo en entornos agresivos como el álcali concentrado y el agua regia. Esta estabilidad es crucial para mantener la integridad y eficacia del proceso electrolítico, especialmente en entornos industriales en los que la exposición prolongada a sustancias corrosivas es inevitable. La naturaleza inerte del PTFE garantiza que no reaccione con el electrolito ni con otros componentes de la célula, minimizando así las posibles interrupciones y prolongando la vida operativa de la célula.
Por otro lado, el vidrio ofrece sus propias ventajas, sobre todo en aplicaciones en las que la transparencia es esencial para controlar el proceso electrolítico. Sin embargo, su susceptibilidad a la corrosión en entornos fuertemente alcalinos limita su uso en determinados contextos. A pesar de ello, el vidrio sigue siendo una opción popular para experimentos a escala de laboratorio y demostraciones educativas debido a su rentabilidad y facilidad de fabricación.

En resumen, la elección entre vidrio y PTFE depende de los requisitos específicos del proceso electrolítico, incluidos el entorno químico, la longevidad operativa y las consideraciones económicas.
Diafragma para celdas electrolíticas
El diafragma de una célula electrolítica desempeña una función crítica al separar el electrodo de trabajo del electrodo auxiliar. Uno de los materiales más utilizados para este fin es el vidrio poroso. Esta elección no es arbitraria; el vidrio poroso ofrece varias ventajas que mejoran el rendimiento y la precisión del proceso electrolítico.
En primer lugar, el vidrio poroso garantiza una distribución uniforme de la corriente en toda la célula. Esta uniformidad es esencial para mantener mediciones coherentes y fiables. Al proporcionar una vía consistente para el flujo de corriente, el vidrio poroso ayuda a minimizar las fluctuaciones y los errores en los datos recogidos.
En segundo lugar, el uso de vidrio poroso como diafragma reduce las interferencias del electrodo auxiliar. En las celdas electrolíticas, los productos generados en el electrodo auxiliar pueden a veces difundirse en el entorno del electrodo de trabajo, provocando reacciones no deseadas y sesgando los resultados. Los finos poros del vidrio actúan como barrera, impidiendo esta contaminación cruzada y preservando la integridad del entorno del electrodo de trabajo.
Además, el vidrio poroso es muy resistente a los ataques químicos lo que lo hace adecuado para su uso en una variedad de soluciones electrolíticas. Esta estabilidad química garantiza que el diafragma siga siendo eficaz durante largos periodos, incluso en condiciones adversas.
En resumen, la selección del vidrio poroso como material de diafragma se debe a su capacidad para proporcionar una distribución uniforme de la corriente, reducir las interferencias y mantener la estabilidad química, factores todos ellos cruciales para el funcionamiento preciso y fiable de las células electrolíticas.
Electrolito
Los electrolitos inertes desempeñan un papel fundamental en el diseño de las células electrolíticas, sobre todo para evitar la migración de sustancias activas que podrían interferir en las reacciones químicas previstas. La concentración de estos electrolitos inertes debe ser significativamente superior a la de las sustancias activas para garantizar su eficacia. Normalmente, la concentración debe ser al menos 100 veces superior a la de la sustancia activa. Esta alta concentración actúa como barrera, minimizando el potencial de contaminación cruzada y garantizando la estabilidad y fiabilidad del proceso electrolítico.
Por ejemplo, en la producción industrial de metales, donde el control preciso de las reacciones químicas es crucial, el uso de electrolitos inertes garantiza que las reacciones primarias no se vean comprometidas por la presencia de otras especies reactivas. Esta elevada proporción de concentración no sólo estabiliza el entorno electrolítico, sino que también aumenta la eficacia del proceso, reduciendo la probabilidad de reacciones secundarias no deseadas. Así pues, la cuidadosa selección y gestión de electrolitos inertes son componentes esenciales en el diseño y funcionamiento de las celdas electrolíticas.
Dispositivo de ventilación de la célula electrolítica
Los canales de entrada y salida son componentes esenciales de una célula electrolítica, diseñados para facilitar los procesos de desoxigenación y adsorción de gases. La configuración de estos canales es crítica para mantener la eficiencia y seguridad del proceso electrolítico. Normalmente, la entrada se sitúa estratégicamente en la parte inferior de la célula, lo que garantiza que el gas entrante se distribuya uniformemente por el electrolito. Esta colocación en la parte inferior ayuda a que los gases se mezclen completamente con el electrolito, promoviendo una desoxigenación eficaz.
La salida, por su parte, está equipada con un mecanismo de sellado de agua. Este sello de agua cumple múltiples funciones: impide el reflujo de gas desde la salida, garantiza una liberación controlada de gases y mantiene una presión estable dentro de la célula. Al disponer de un sello de agua, la célula electrolítica puede funcionar en condiciones óptimas, reduciendo el riesgo de fugas de gas y garantizando que el entorno dentro de la célula permanezca estable y propicio para el proceso electrolítico.
En resumen, el diseño cuidadoso de los canales de entrada y salida, con la entrada en la parte inferior y la salida con un sello de agua, es crucial para la desoxigenación efectiva y la adsorción de gas en las celdas electrolíticas, mejorando así la eficiencia general y la seguridad del proceso.
Puente salino para celdas electrolíticas
El puente salino es un componente esencial en las celdas electrolíticas, ya que sirve como conducto que conecta los electrodos de referencia y de investigación. Esta conexión es crucial para mantener la neutralidad eléctrica dentro de la célula, facilitando así el flujo fluido de iones y completando el circuito eléctrico. El puente salino suele estar compuesto por un electrolito fuerte, como el cloruro sódico o el nitrato potásico, que se aloja en un tubo de vidrio en forma de U o se impregna en materiales porosos como el papel de filtro.
Una de las principales funciones del puente salino es mitigar el potencial de contacto líquido, un fenómeno que se produce cuando dos electrolitos diferentes entran en contacto, dando lugar a una diferencia de potencial. Al garantizar que la solución electrolítica del puente salino es inerte y no reactiva con otras soluciones, se minimiza el riesgo de reacciones químicas no deseadas. Esta inercia permite el movimiento sin obstáculos de los iones entre las dos semicélulas, manteniendo una distribución de carga en estado estacionario y evitando la contaminación.
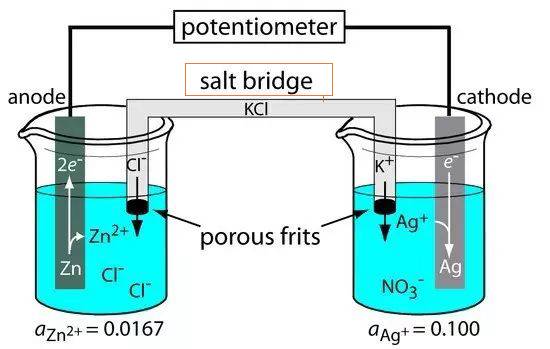
Existen dos tipos comunes de puentes salinos: el puente de tubo de vidrio y el puente de papel de filtro. El puente de tubo de vidrio, como su nombre indica, es un tubo en forma de U lleno de electrolitos, mientras que el puente de papel de filtro utiliza papel de filtro poroso empapado en soluciones electrolíticas. Ambos tipos sirven para lo mismo, pero difieren en su estructura física y facilidad de uso.
En aplicaciones prácticas, como la construcción de células galvánicas o voltaicas, el puente salino desempeña un papel fundamental. Cuando los electrones fluyen de una semicelda a otra a través de un circuito externo, se establece una diferencia de carga. Sin el puente salino, esta diferencia de carga detendría rápidamente el flujo de electrones. El puente salino permite el movimiento continuo de iones, garantizando que la distribución de la carga permanezca estable y que la célula funcione eficazmente.
En resumen, el puente salino es un elemento fundamental en las células electrolíticas, ya que permite el flujo continuo de iones y mantiene la neutralidad eléctrica. Su diseño y composición se eligen cuidadosamente para evitar reacciones no deseadas y garantizar la integridad del proceso electroquímico.
Tubo capilar Rukin para celda electrolítica
El tubo capilar Rukin desempeña un papel fundamental en el diseño de las celdas electrolíticas, especialmente en el mantenimiento de una resistencia mínima entre los electrodos de referencia y de trabajo. Esta característica crítica es esencial para lograr un control preciso del potencial, que es fundamental para la precisión y fiabilidad de los procesos electrolíticos.
Funciones clave del tubo capilar Rukin
-
Resistencia mínima: La función principal del tubo capilar Rukin es garantizar que la resistencia eléctrica entre los electrodos de referencia y de trabajo se mantenga en un mínimo absoluto. Esto se consigue gracias al diseño del tubo, que permite una conductividad eléctrica eficaz sin pérdidas ni interferencias significativas.
-
Control preciso del potencial: Al facilitar una resistencia mínima, el tubo capilar Rukin permite un control más preciso de la diferencia de potencial entre los electrodos. Esta precisión es crucial para diversas aplicaciones electrolíticas, desde la producción industrial de metales hasta la investigación científica, donde incluso pequeñas desviaciones en el potencial pueden dar lugar a errores significativos.
-
Estabilidad mejorada: El diseño del tubo capilar Rukin también contribuye a la estabilidad general de la célula electrolítica. Al reducir la probabilidad de fluctuaciones de potencial, ayuda a mantener un entorno consistente y estable para el proceso electrolítico.
Consideraciones sobre materiales y diseño
-
Selección de materiales: El tubo capilar Rukin se fabrica normalmente con materiales que ofrecen una alta conductividad eléctrica y resistencia química, como el platino o el oro. Estos materiales garantizan que el tubo pueda soportar las duras condiciones de los procesos electrolíticos sin degradarse.
-
Geometría del tubo: La geometría del tubo capilar Rukin está cuidadosamente diseñada para optimizar el flujo de corriente eléctrica. Esto incluye consideraciones sobre la longitud del tubo, el diámetro y la ubicación de los canales de entrada y salida, todo lo cual contribuye a minimizar la resistencia y mejorar la conductividad.
En resumen, el tubo capilar Rukin es un componente indispensable en el diseño de celdas electrolíticas, ya que ofrece una solución robusta para garantizar una resistencia mínima y un control preciso del potencial. Su cuidadosa selección de materiales y su diseño optimizado lo convierten en un elemento clave para lograr resultados electrolíticos fiables y precisos.
Tipos de celdas electrolíticas
Célula electrolítica monocámara
Las celdas electrolíticas monocámara están diseñadas específicamente para estudios de corrosión, donde tanto los electrodos de investigación como los auxiliares se alojan dentro de la misma cámara. Esta configuración simplifica el montaje al eliminar la necesidad de una compleja compartimentación, lo que la convierte en la opción ideal para los investigadores que se centran en los mecanismos de corrosión.

En estas celdas, la proximidad de los electrodos de investigación y auxiliares permite la monitorización en tiempo real de los procesos de corrosión. Esto resulta especialmente ventajoso en estudios en los que se observan cambios rápidos en el potencial de los electrodos, ya que minimiza el lapso de tiempo entre las mediciones. Además, el diseño de una sola cámara reduce el riesgo de contaminación que podría surgir de cámaras separadas, lo que garantiza una recopilación de datos más precisa y coherente.
Además, el uso de una sola cámara facilita el control del entorno electrolítico. Los investigadores pueden ajustar con precisión la composición y concentración del electrolito, así como la temperatura y la presión dentro de la cámara, para simular diversas condiciones de corrosión. Esta adaptabilidad es crucial para comprender cómo influyen los distintos factores en las velocidades y patrones de corrosión.
A pesar de sus ventajas, la configuración de una sola cámara tiene limitaciones. Por ejemplo, la falta de un diafragma significa que no existe una barrera física que separe los productos del electrodo de investigación de los del electrodo auxiliar. Esto puede provocar posibles interferencias en las mediciones, sobre todo en estudios con sustancias muy reactivas o volátiles. Por lo tanto, aunque el diseño de una sola cámara es práctico para muchos estudios de corrosión, puede no ser adecuado para todas las condiciones experimentales.
Celda electrolítica de doble cámara
La célula electrolítica de doble cámara está diseñada para mitigar la interferencia de los productos del electrodo auxiliar empleando un diafragma que separa el electrodo de trabajo del electrodo auxiliar. Esta configuración es especialmente ventajosa para reducir la contaminación cruzada y garantizar mediciones más precisas.

Principales características y ventajas
- Material del diafragma: Construido normalmente con vidrio poroso, el diafragma permite el paso de iones al tiempo que evita el contacto directo de los productos del electrodo, manteniendo así la integridad del entorno de trabajo.
- Distribución uniforme de la corriente: El diafragma asegura una distribución uniforme de la corriente a través de la célula electrolítica, lo que es crucial para obtener resultados consistentes y fiables.
- Interferencia reducida: Al aislar el electrodo de trabajo del electrodo auxiliar, el diseño de doble cámara reduce significativamente la posibilidad de interferencias, mejorando la precisión de los datos recogidos.
Aplicaciones y ventajas
- Estudios de corrosión: La configuración de doble cámara es especialmente beneficiosa en estudios de corrosión en los que es esencial mantener la pureza del electrodo de trabajo.
- Mediciones de precisión: Para aplicaciones que requieren una gran precisión, como la química analítica, la célula de doble cámara proporciona un entorno controlado que minimiza las influencias externas.
Este diseño no sólo mejora la precisión de las mediciones, sino que también prolonga la vida operativa de los electrodos al reducir la exposición a subproductos potencialmente dañinos.
Tipos de electrólisis basados en la generación de productos
Tipo de electrólisis del agua
La electrólisis del agua es un proceso fundamental que se produce en condiciones específicas, en las que intervienen principalmente ácidos oxigenados , bases fuertes y soluciones de sales ácidas oxigenadas de metales activos . Este tipo de electrólisis se caracteriza por la descomposición de las moléculas de agua en gases de hidrógeno y oxígeno, una reacción que es a la vez científicamente intrigante e industrialmente significativa.
Para comprender la electrólisis del agua, es esencial profundizar en la naturaleza de los electrolitos implicados. Ácidos oxigenados como el ácido nítrico (HNO₃) y el ácido sulfúrico (H₂SO₄), contienen átomos de oxígeno unidos al átomo central, lo que facilita la liberación de oxígeno durante el proceso de electrólisis. De forma similar, bases fuertes como el hidróxido de sodio (NaOH) y el hidróxido de potasio (KOH) proporcionan un entorno altamente alcalino que favorece la disociación de las moléculas de agua.

En el contexto de soluciones de sales ácidas oxigenadas de metales activos como el nitrato de sodio (NaNO₃) o el sulfato de potasio (K₂SO₄), la presencia de metales activos como el sodio (Na) o el potasio (K) aumenta la conductividad de la solución, facilitando así el proceso de electrólisis. Estas sales, al disolverse en el agua, crean un medio conductor en el que los metales activos actúan como portadores de carga, favoreciendo el flujo de electrones necesario para que se produzca la electrólisis.
La electrólisis del agua no sólo es un proceso clave en diversas aplicaciones industriales, como la producción de hidrógeno gaseoso para pilas de combustible, sino que también constituye un concepto fundamental en electroquímica. Comprender las condiciones específicas en las que se produce este proceso -ya sea en presencia de ácidos oxigenados, bases fuertes o soluciones salinas ácidas oxigenadas de metales activos- es crucial para optimizar el diseño de las celdas electrolíticas y garantizar una conversión eficiente de la energía.
Descomposición del tipo de electrolito
La descomposición del tipo de electrolito es un proceso específico que se produce en determinadas condiciones, especialmente con ácidos sin oxígeno y soluciones que contienen metales inactivos y sales sin oxígeno. Este tipo de electrólisis se distingue de los demás por la ausencia de oxígeno, que influye significativamente en las reacciones químicas en los electrodos.
En entornos sin oxígeno, los ácidos y las sales no contribuyen a la formación de gas oxígeno, que es un subproducto habitual en muchos procesos de electrólisis. En su lugar, la atención se centra en la interacción directa entre el electrolito y los electrodos, que conduce a la descomposición del propio electrolito. Este proceso es crucial en aplicaciones industriales en las que mantener un entorno libre de oxígeno es esencial para evitar la contaminación y garantizar la pureza de los productos finales.
Por ejemplo, en la producción de ciertos metales, el uso de ácidos y sales sin oxígeno puede evitar la formación de óxidos, que de otro modo podrían comprometer la calidad del metal. La ausencia de oxígeno también simplifica los pasos posteriores al tratamiento, ya que no es necesario eliminar las impurezas del producto basadas en el oxígeno.
En resumen, la descomposición de tipo electrolítico se caracteriza por su dependencia de condiciones libres de oxígeno, que no sólo alteran las vías químicas, sino que también mejoran la eficacia y la pureza de los productos resultantes.
Tipo alcalino de liberación de hidrógeno
El tipo de electrólisis alcalina de liberación de hidrógeno es un proceso específico que se produce en presencia de metales activos y soluciones ácidas anaeróbicas. Este tipo de electrólisis se caracteriza por la liberación de hidrógeno gaseoso en el cátodo, que es el resultado directo de la reducción de los iones de hidrógeno presentes en la solución ácida anaeróbica. Los metales activos, que suelen ser metales alcalinos o alcalinotérreos, desempeñan un papel crucial en este proceso al proporcionar los electrones necesarios para la reacción de reducción.
La naturaleza anaeróbica de la solución ácida es esencial para evitar la formación de gas oxígeno, que de otro modo complicaría el proceso de electrólisis. En un entorno anaeróbico, los iones de hidrógeno son la principal especie que experimenta la reducción, lo que conduce a la producción eficaz de hidrógeno gaseoso. Este proceso es especialmente significativo en aplicaciones industriales en las que la producción de hidrógeno gaseoso es un objetivo clave, como en la producción de determinados productos químicos o en la tecnología de pilas de combustible.
Para facilitar este tipo de electrólisis, la célula electrolítica debe diseñarse con consideraciones específicas. A menudo se emplea un diafragma, como el vidrio poroso, para separar el electrodo de trabajo del electrodo auxiliar, lo que garantiza una distribución uniforme de la corriente y minimiza las interferencias de los productos del electrodo auxiliar. Además, la concentración de electrolito debe controlarse cuidadosamente para evitar la migración de sustancias activas, lo que podría afectar negativamente al proceso de electrólisis.
En resumen, el tipo de electrólisis alcalina de liberación de hidrógeno es un proceso especializado que aprovecha la reactividad de los metales activos y las propiedades de las soluciones ácidas anaeróbicas para producir hidrógeno gaseoso de forma eficiente. El diseño adecuado de la célula electrolítica y la selección de materiales son fundamentales para garantizar el éxito de este proceso en aplicaciones industriales.
Tipo de ácido generador de oxígeno
El tipo ácido generador de oxígeno de electrólisis se caracteriza por producirse con soluciones de oxigenados metálicos inactivos. Estas soluciones, que incluyen compuestos como nitratos y sulfatos, son particularmente significativas en aplicaciones industriales donde la generación de oxígeno es un proceso crítico.
En este tipo de electrólisis, los metales inactivos, que no participan fácilmente en las reacciones químicas, desempeñan un papel crucial. Los oxigenados de la solución actúan como fuente primaria de oxígeno, facilitando el proceso electrolítico. La estabilidad de estos metales inactivos garantiza que la célula electrolítica pueda funcionar eficazmente sin riesgo de contaminación o reacciones no deseadas.
El proceso implica la descomposición de los oxigenados, lo que conduce a la liberación de gas oxígeno en el ánodo. Esta liberación es el resultado directo de la acción electrolítica, en la que la corriente eléctrica aplicada hace que los oxigenados se descompongan en sus elementos constituyentes. Los metales inactivos permanecen prácticamente inalterados, manteniendo la integridad y pureza del entorno electrolítico.
Los factores clave a tener en cuenta en este tipo de electrólisis incluyen la concentración de los oxigenados en la solución y la estabilidad de los metales inactivos. La concentración debe controlarse cuidadosamente para garantizar una generación óptima de oxígeno, mientras que los metales deben elegirse en función de su inercia para evitar cualquier interferencia con el proceso electrolítico.
En general, el tipo ácido generador de oxígeno de la electrólisis es esencial en industrias en las que es necesario un control preciso de la producción de oxígeno, como en el refinado de metales y en determinados procesos de fabricación de productos químicos.
Conversión de energía y condiciones de la electrólisis
Características del cátodo y del ánodo
En los procesos electrolíticos, las funciones del cátodo y del ánodo pueden variar significativamente en función de la reacción específica que se produzca en la célula. Aunque estos electrodos son componentes fundamentales de la célula electrolítica, su participación en la reacción química no siempre es directa.
El cátodo, normalmente el lugar de reducción, y el ánodo, donde se produce la oxidación, no participan necesariamente de forma directa en la reacción. Esto significa que los propios electrodos pueden permanecer químicamente inertes durante todo el proceso, sirviendo simplemente como conductos para el flujo de electrones. Por ejemplo, en algunas células electrolíticas, los electrodos están hechos de materiales como el platino o el grafito, conocidos por su estabilidad química y su resistencia a la reacción en las condiciones de la electrólisis.
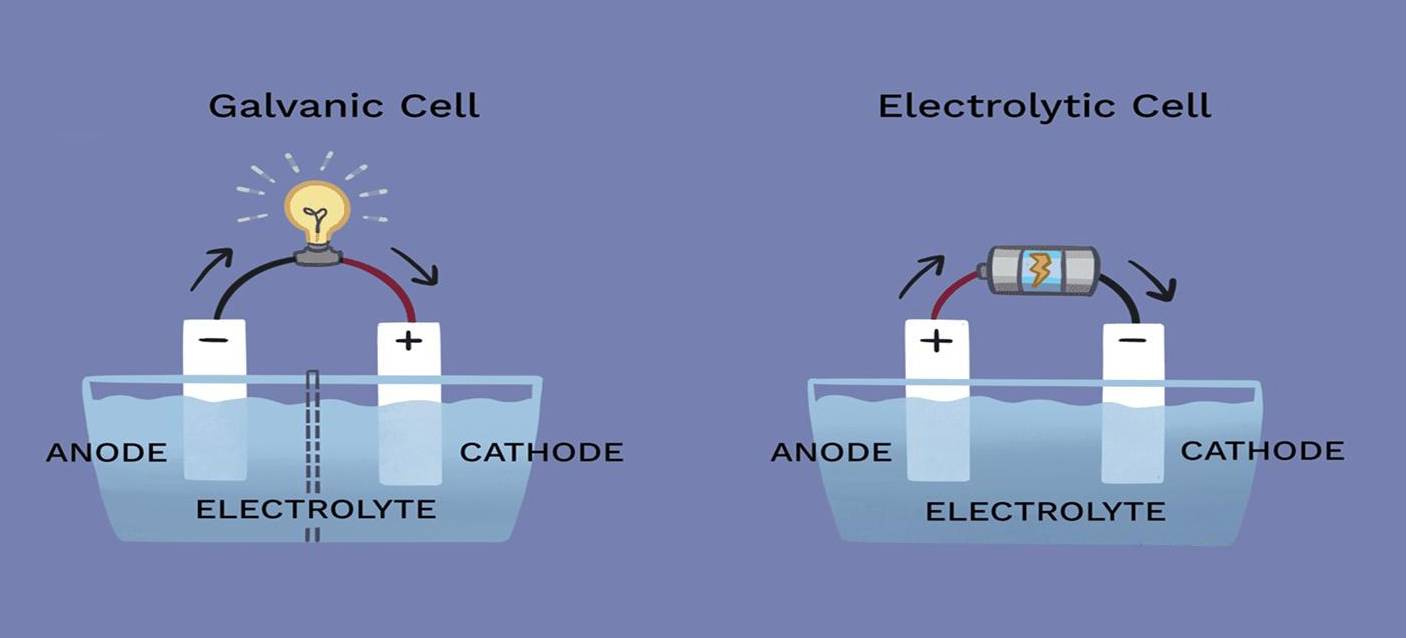
Además, el requisito de inercia no es universal. En determinadas aplicaciones, se emplean electrodos activos que pueden sufrir cambios durante el proceso. Estos electrodos activos pueden influir en la dinámica de la reacción, alterando potencialmente la eficacia o el resultado de la electrólisis. Por lo tanto, la elección entre electrodos inertes y activos es una consideración de diseño crítica que influye en el rendimiento general y la eficacia de la célula electrolítica.
Condiciones para la electrólisis
La electrólisis es un proceso que requiere condiciones específicas para funcionar eficazmente. En esencia, la electrólisis requiere Una fuente de alimentación de corriente continua (CC) . Esto garantiza un flujo constante de energía eléctrica, esencial para impulsar las reacciones químicas en los electrodos.
La configuración incluye distintas conexiones para el cátodo y ánodo . El cátodo, que atrae a los cationes, suele conectarse al terminal negativo de la fuente de alimentación de corriente continua, mientras que el ánodo, que atrae a los aniones, se conecta al terminal positivo. Estas conexiones son cruciales para la correcta dirección del flujo de electrones y las transformaciones químicas subsiguientes.
Para que se produzca la electrólisis, los electrodos deben estar sumergidos en una solución electrolítica o en un electrolito fundido . El electrolito sirve de medio a través del cual pueden moverse los iones, facilitando la conducción de la electricidad. La elección del electrolito es fundamental, ya que debe ser capaz de disociarse en iones que puedan participar en las reacciones electroquímicas.
Por último, un circuito cerrado para completar la vía eléctrica. Esto garantiza que los electrones puedan fluir del ánodo al cátodo a través del circuito externo, mientras que los iones se mueven a través de la solución electrolítica. Sin un circuito cerrado, el flujo de electricidad se interrumpiría y el proceso de electrólisis cesaría.
Productos relacionados
- Celda electrolítica para corrosión plana
- Célula electrolítica electroquímica de cinco puertos
- Celda Electrolítica Tipo H Triple Celda Electroquímica
- Célula electrolítica de baño de agua de cinco puertos de doble capa
- Bañera de agua para celda electrolítica electroquímica multifuncional de una o dos capas
Artículos relacionados
- Técnicas avanzadas de evaluación de revestimientos mediante celdas electrolíticas
- Comprensión de los electrodos y las celdas electroquímicas
- Aplicaciones de celdas electrolíticas en purificación y galvanoplastia
- Exploración del baño de agua multifuncional para celdas electrolíticas: Aplicaciones y ventajas
- Técnicas avanzadas de celdas electrolíticas para investigación de laboratorio de vanguardia














