En resumen, el electrodo de platino en un Electrodo Estándar de Hidrógeno (EEN) funciona como una superficie inerte catalíticamente activa. Proporciona el sitio físico donde puede ocurrir la reacción del hidrógeno y reduce la energía de activación requerida, permitiendo que la celda alcance un equilibrio estable y medible sin que el electrodo mismo se consuma.
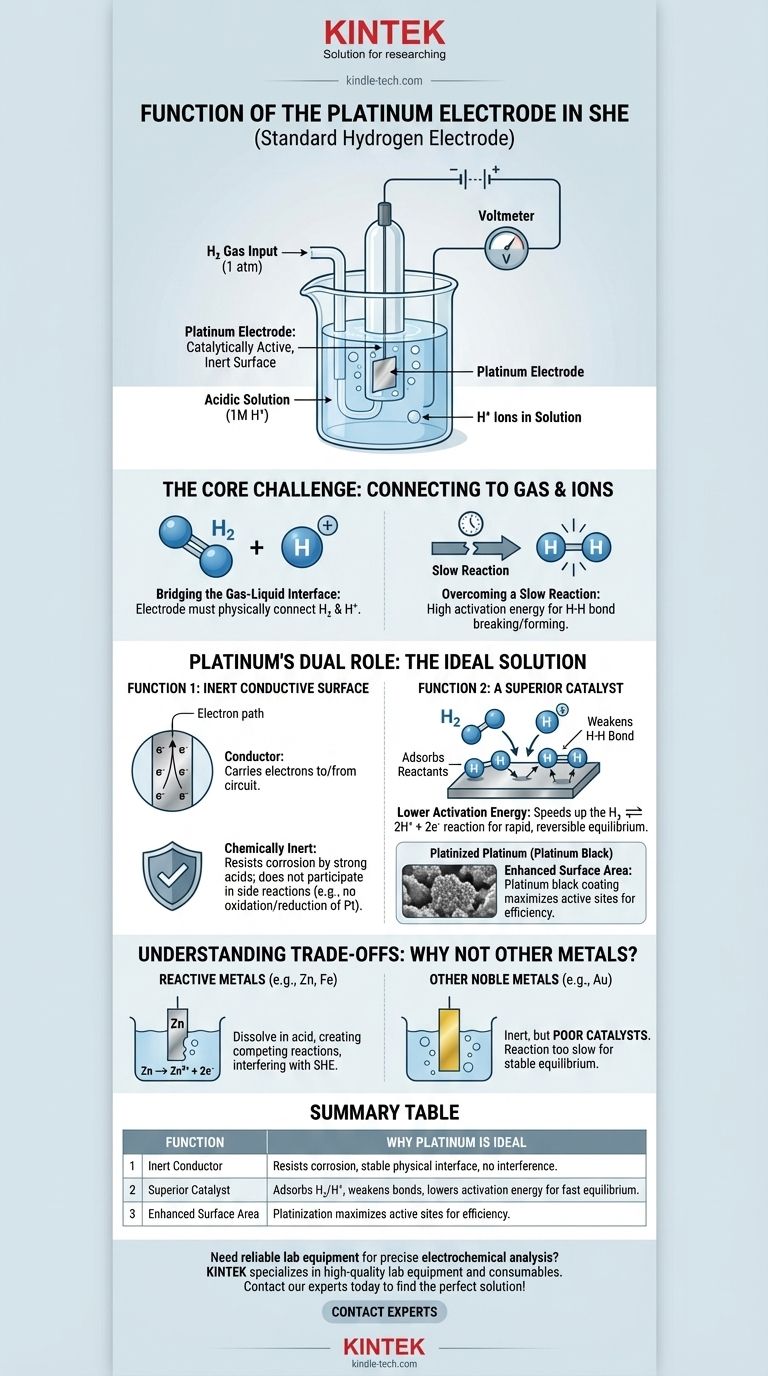
El desafío central del EEN es crear una conexión eléctrica fiable para una reacción que involucra un gas (H₂) y un ion (H⁺). El platino es excepcionalmente adecuado para este papel porque es un excelente catalizador para la reacción del hidrógeno y un conductor químicamente inerte, lo que garantiza que facilita la reacción sin interferir en ella.

El Desafío Central: Conectar un Circuito a un Gas
Para comprender la función del platino, primero debemos reconocer el problema fundamental en la construcción de un Electrodo Estándar de Hidrógeno. El objetivo es medir el potencial de la reacción redox del hidrógeno: 2H⁺(aq) + 2e⁻ ⇌ H₂(g).
Unir la Interfaz Gas-Líquido
La reacción involucra iones de hidrógeno disueltos en una solución ácida y gas hidrógeno burbujeando sobre el electrodo. Un electrodo debe existir físicamente en este entorno para suministrar o aceptar electrones de un circuito externo.
Superar una Reacción Lenta
Esta reacción del hidrógeno no ocurre de manera rápida o eficiente por sí sola. La energía requerida para romper el enlace H-H en una molécula de hidrógeno o para combinar dos iones de hidrógeno es alta. Sin ayuda, el sistema no alcanzaría un equilibrio rápido y reversible, lo que lo haría inútil como estándar de referencia.
El Doble Papel del Platino: La Solución Ideal
El platino se elige porque resuelve ambos problemas simultáneamente. Actúa como conductor físico inerte y como catalizador químico activo.
Función 1: Una Superficie Conductora Inerte
Primero, el electrodo debe ser un conductor para transportar electrones hacia o desde el circuito externo. Fundamentalmente, también debe ser químicamente inerte.
No debe reaccionar con el ácido fuerte (típicamente 1M HCl) ni ser oxidado o reducido él mismo. El platino es un metal noble, lo que significa que es extremadamente resistente a la corrosión y la disolución, lo que lo convierte en la base física estable perfecta para el electrodo.
Función 2: Un Catalizador Superior
Esta es la función más crítica del platino. Acelera drásticamente la reacción redox del hidrógeno.
La superficie del platino adsorbe tanto las moléculas de gas hidrógeno (H₂) como los iones de hidrógeno (H⁺). Piense en la superficie de platino como un banco de trabajo que mantiene a los reactivos en su lugar, facilitando su interacción.
Al adsorber el gas hidrógeno, la superficie de platino debilita el fuerte enlace covalente H-H, haciendo mucho más fácil dividir la molécula en átomos individuales que luego pueden oxidarse a iones H⁺. Esta acción catalítica es lo que permite que la reacción proceda de forma rápida y reversible.
El Papel del "Platino Platinado"
Para maximizar este efecto, el electrodo a menudo se recubre con una capa de polvo de platino finamente dividido, conocido como negro de platino. Este proceso, llamado platinización, aumenta drásticamente el área superficial efectiva del electrodo, proporcionando muchos más sitios activos para la catálisis y asegurando que el electrodo funcione eficientemente.
Comprender las Compensaciones: ¿Por qué no otros metales?
Examinar por qué otros metales fallan ayuda a aclarar por qué el platino es la elección definitiva.
El Problema con los Metales Reactivos
Metales como el zinc, el hierro o el aluminio son altamente reactivos. Si se colocan en la solución ácida del EEN, simplemente se disolverían (Zn → Zn²⁺ + 2e⁻). Esto crea una reacción electroquímica competitiva que interferiría completamente con la función del electrodo de hidrógeno.
El Problema con Otros Metales Nobles
Otros metales inertes, como el oro, podrían servir como conductor inerte. Sin embargo, el oro es un catalizador significativamente peor para la reacción del hidrógeno en comparación con el platino. Aunque un electrodo de oro no se corroería, la reacción sería demasiado lenta para establecer un potencial de equilibrio fiable y reproducible, lo que anularía el propósito de un electrodo "estándar".
Tomar la Decisión Correcta para su Objetivo
Comprender la doble función del platino es clave para captar los principios fundamentales de la electroquímica y los estándares de referencia.
- Si su enfoque principal está en la cinética de la reacción: Recuerde que el propósito principal del platino es actuar como un catalizador heterogéneo, reduciendo la energía de activación tanto para las reacciones de hidrógeno hacia adelante como hacia atrás.
- Si su enfoque principal está en el diseño de la celda: Recuerde que el material del electrodo debe ser un conductor inerte que proporcione una interfaz física estable sin participar en ninguna reacción secundaria que interfiera.
La selección del platino es una elección de ingeniería deliberada que permite que el electrodo de hidrógeno sirva como el punto cero universal para todas las mediciones electroquímicas.
Tabla Resumen:
| Función | Por qué el Platino es Ideal |
|---|---|
| Conductor Inerte | Resiste la corrosión en ácido, proporciona una interfaz física estable sin reacciones que interfieran. |
| Catalizador Superior | Adsorbe H₂ y H⁺, debilita los enlaces H-H y reduce la energía de activación para un equilibrio rápido y reversible. |
| Área Superficial Mejorada | La platinización (recubrimiento de negro de platino) maximiza los sitios activos para un rendimiento eficiente. |
¿Necesita equipo de laboratorio fiable para un análisis electroquímico preciso? KINTEK se especializa en equipos y consumibles de laboratorio de alta calidad, asegurando que su laboratorio logre resultados precisos y consistentes. Contacte a nuestros expertos hoy mismo para encontrar la solución perfecta para sus necesidades de investigación.
Guía Visual
Productos relacionados
- Electrodo de Lámina de Platino para Aplicaciones de Laboratorio e Industriales
- Electrodo de Referencia Calomel Plata Cloruro Mercurio Sulfato para Uso en Laboratorio
- Electrodo de disco de platino giratorio para aplicaciones electroquímicas
- Electrodo Auxiliar de Platino para Uso en Laboratorio
- Electrodo de Disco de Oro
La gente también pregunta
- ¿Por qué se requiere un electrodo de referencia Ag/AgCl de alta pureza para las MFC? Garantice la precisión en las pruebas de celdas de combustible microbianas
- ¿Cómo se puede mantener la estabilidad funcional y la integridad estructural de un electrodo de referencia de vidrio? Guía experta
- ¿Cuáles son las aplicaciones principales de los cepillos de fibra de carbono en los experimentos? Servir como ánodos superiores en pruebas bioelectroquímicas
- ¿Por qué se seleccionan comúnmente los electrodos de carbono serigrafiados (SPCE) para la caracterización de PB/PEI? Beneficios clave de eficiencia
- ¿Cómo se debe mantener y limpiar regularmente un electrodo de titanio? Proteja su inversión y maximice el rendimiento
- ¿Qué electrodo se utiliza como referencia de tierra? Domine la clave para mediciones electroquímicas precisas
- ¿Cuáles son las ventajas de usar espuma de níquel o malla de níquel de alta porosidad? Potencie el rendimiento de su MEC
- ¿Cómo se compara un montaje de electrodo de difusión de gas (GDE) con un electrodo de disco giratorio (RDE)? Simular condiciones reales



















