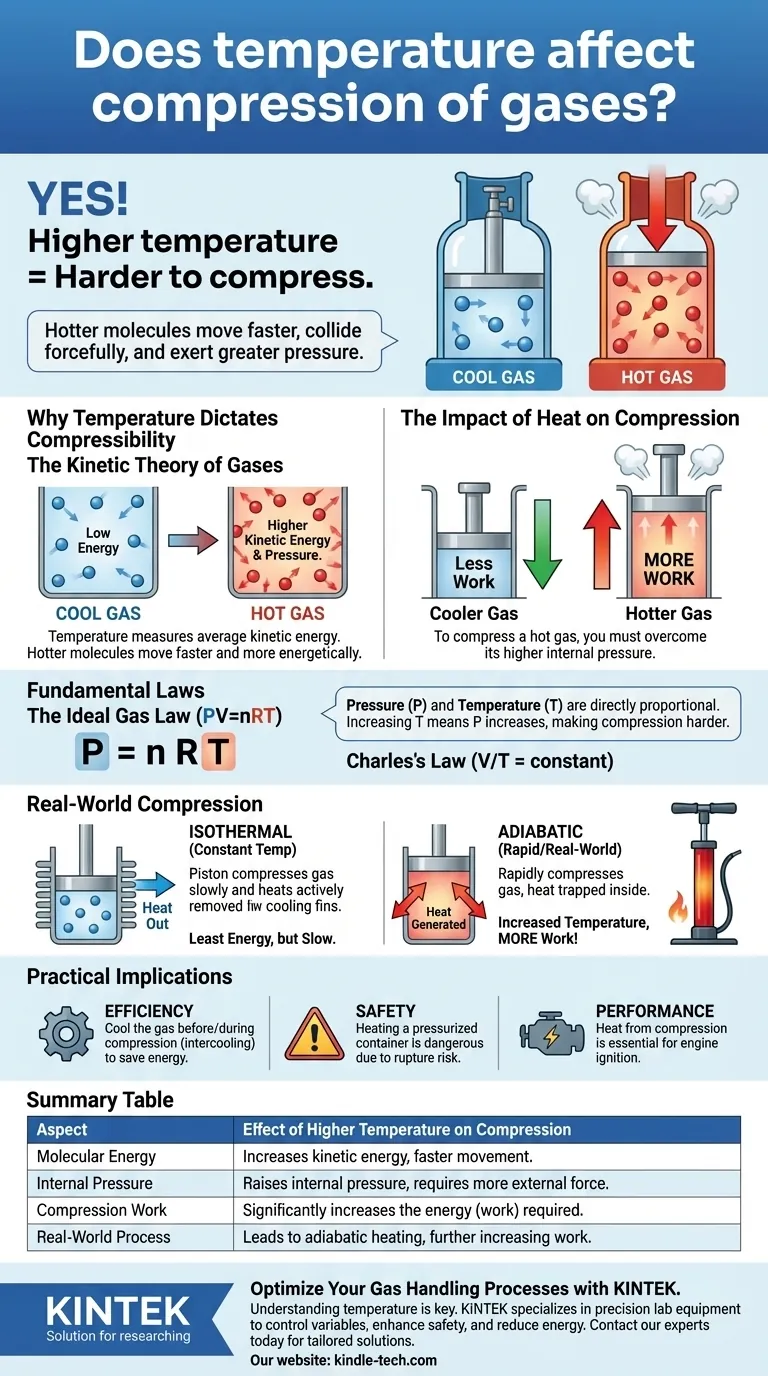
Sí, la temperatura tiene un efecto directo y crítico en la compresión de los gases. Un gas a una temperatura más alta es significativamente más difícil de comprimir que el mismo gas a una temperatura más baja. Esto se debe a que la temperatura es una medida de la energía cinética de las moléculas de gas; las moléculas más calientes se mueven más rápido, chocan con más fuerza contra las paredes de su contenedor y, por lo tanto, ejercen una mayor presión que debe superarse.
El principio fundamental es que comprimir un gas requiere trabajo para superar la presión ejercida por sus moléculas. Dado que un gas más caliente ejerce más presión a un volumen dado, requiere más trabajo para comprimirse.

Por qué la temperatura dicta la compresibilidad
Para comprender la relación entre la temperatura y la compresión, debemos observar el comportamiento de las moléculas de gas. Esto se explica por la teoría cinética de los gases.
La teoría cinética de los gases
La temperatura es una medida macroscópica de la energía cinética promedio de las moléculas en una sustancia. Temperaturas más altas significan que las moléculas de gas individuales se mueven más rápido y con más energía.
Un gas frío tiene moléculas con menor energía cinética promedio, lo que significa que se mueven más lentamente. Un gas caliente tiene moléculas con mayor energía cinética promedio, lo que hace que se muevan mucho más rápido.
La presión como resultado de las colisiones moleculares
La presión que ejerce un gas es el resultado de innumerables moléculas que chocan con las paredes de su contenedor. Cada colisión imparte una pequeña cantidad de fuerza.
Cuando las moléculas están más calientes y se mueven más rápido, golpean las paredes del contenedor con mayor frecuencia y con mayor fuerza, lo que resulta en una mayor presión.
El impacto del calor en la compresión
Comprimir un gas significa forzar sus moléculas a un volumen más pequeño. Para hacer esto, debe aplicar una presión externa que sea mayor que la presión interna del gas.
Debido a que un gas caliente ejerce naturalmente una presión interna más alta, debe aplicar una fuerza externa significativamente mayor para comprimirlo al mismo volumen que un gas más frío.
Las leyes fundamentales en juego
Esta relación no es solo teórica; está descrita con precisión por leyes fundamentales de los gases que forman la base de la termodinámica.
La Ley de los Gases Ideales (PV=nRT)
La Ley de los Gases Ideales es la ecuación unificadora: Presión (P) × Volumen (V) = moles de gas (n) × constante de los gases (R) × Temperatura (T).
Esta ecuación muestra que la presión y la temperatura son directamente proporcionales. Si se mantiene el volumen constante y se aumenta la temperatura (T), la presión (P) también debe aumentar. Esto confirma por qué un gas más caliente es más difícil de comprimir: comienza o se acumula a una presión más alta.
Ley de Charles (V/T = constante)
La Ley de Charles establece que para una cantidad fija de gas a presión constante, el volumen es directamente proporcional a su temperatura absoluta.
Si bien esto describe la expansión al calentar, su inverso es igualmente cierto para la compresión. Para mantener una presión constante mientras se reduce el volumen, se tendría que reducir proporcionalmente la temperatura.
Realidades prácticas y compensaciones clave
En aplicaciones del mundo real, el propio proceso de compresión introduce una complicación crítica: el calor.
El caso idealizado: compresión isotérmica
La compresión isotérmica asume que la temperatura del gas se mantiene perfectamente constante durante todo el proceso.
Para lograr esto, necesitaría eliminar activa y continuamente el calor que se genera por el acto de compresión. Este proceso requiere la menor cantidad de energía (trabajo) pero a menudo es lento e impráctico.
El caso del mundo real: compresión adiabática
En casi todos los escenarios de compresión rápida, como en el cilindro de un motor o una bomba de bicicleta, el proceso es más cercano al adiabático. Esto significa que no se permite que el calor escape del sistema.
Toda la energía que se invierte en comprimir el gas aumenta su energía interna, provocando un rápido y significativo aumento de la temperatura. Por eso una bomba de neumáticos se calienta durante su uso.
La consecuencia: mayor trabajo requerido
Este calentamiento adiabático juega en su contra. A medida que comprime el gas, su temperatura aumenta, lo que a su vez aumenta aún más su presión interna.
Ahora está luchando contra una fuerza opuesta que aumenta continuamente. Por eso, la compresión en el mundo real siempre requiere más trabajo que el ideal teórico de temperatura constante. Los compresores de varias etapas con intercoolers se utilizan en la industria específicamente para combatir este efecto.
Tomar la decisión correcta para su objetivo
Comprender esta relación es crucial para la eficiencia, la seguridad y el rendimiento en cualquier sistema que involucre gases comprimidos.
- Si su enfoque principal es la eficiencia industrial: Enfriar el gas antes y durante la compresión (un proceso conocido como interenfriamiento) reducirá drásticamente la energía necesaria para comprimirlo.
- Si su enfoque principal es la seguridad: Reconozca que calentar un recipiente sellado y presurizado es extremadamente peligroso porque la presión interna aumentará proporcionalmente con la temperatura, creando un riesgo de ruptura.
- Si su enfoque principal es el rendimiento del motor: El calor generado durante la carrera de compresión de un motor de combustión interna es esencial para encender la mezcla de combustible y aire, convirtiendo esa energía térmica en trabajo mecánico.
En última instancia, la temperatura no es una variable pasiva sino un participante activo en el trabajo de comprimir un gas.
Tabla resumen:
| Aspecto | Efecto de una temperatura más alta en la compresión |
|---|---|
| Energía molecular | Aumenta la energía cinética, haciendo que las moléculas se muevan más rápido. |
| Presión interna | Eleva la presión interna del gas, requiriendo más fuerza externa para comprimir. |
| Trabajo de compresión | Aumenta significativamente la energía (trabajo) requerida para la compresión. |
| Proceso en el mundo real | Conduce a un calentamiento adiabático, aumentando aún más la resistencia y el trabajo necesario. |
Optimice sus procesos de manejo de gases con KINTEK
Comprender la relación crítica entre la temperatura y la compresión de gases es clave para la eficiencia, la seguridad y el rendimiento en cualquier laboratorio o entorno industrial. Ya sea que esté diseñando un nuevo sistema u optimizando uno existente, la gestión de los efectos térmicos es primordial.
KINTEK se especializa en equipos y consumibles de laboratorio de precisión que le ayudan a controlar estas variables. Desde entornos con temperatura controlada hasta sistemas de compresión eficientes, nuestras soluciones están diseñadas para mejorar la seguridad de su flujo de trabajo y reducir el consumo de energía.
Permítanos ayudarle a lograr resultados superiores. Contacte hoy mismo a nuestros expertos a través de nuestro formulario de contacto para discutir cómo nuestras soluciones personalizadas pueden satisfacer sus necesidades y desafíos específicos de laboratorio.
Guía Visual
Productos relacionados
- Fabricante de piezas personalizadas de PTFE Teflon para aplicaciones de válvulas de aire
- Molde de Prensa de Bolas para Laboratorio
- Prensa Hidráulica Manual Calentada con Placas Calentadas para Prensa en Caliente de Laboratorio
- Molde de Prensado de Polígonos para Laboratorio
- Máquina automática de prensa térmica de laboratorio
La gente también pregunta
- ¿Qué es el prensado y sinterizado? Una guía para la fabricación eficiente de forma neta
- ¿Qué material se utiliza en el proceso de sinterización? Descubra el poder de los metales y las cerámicas
- ¿Por qué se utiliza un baño de agua en la evaporación?Garantizar una eliminación eficaz y segura del disolvente
- ¿Qué se puede hacer con una máquina de moldeo por inyección? Producir en masa piezas de plástico de alta calidad de forma eficiente
- ¿Es el diamante un mejor conductor del calor que el grafito? Desvelando los Secretos Atómicos de la Conductividad Térmica
- ¿Cuál es la diferencia entre pirólisis térmica y catalítica? Maximizar el rendimiento vs. Mejorar la calidad del aceite
- ¿Cuáles son los fluidos refrigerantes más eficientes y ecológicos utilizados en los ultracongeladores? Elija hidrocarburos naturales para un laboratorio más ecológico
- ¿La pirólisis cambia la composición química? Sí, transforma fundamentalmente los materiales mediante la descomposición térmica



















