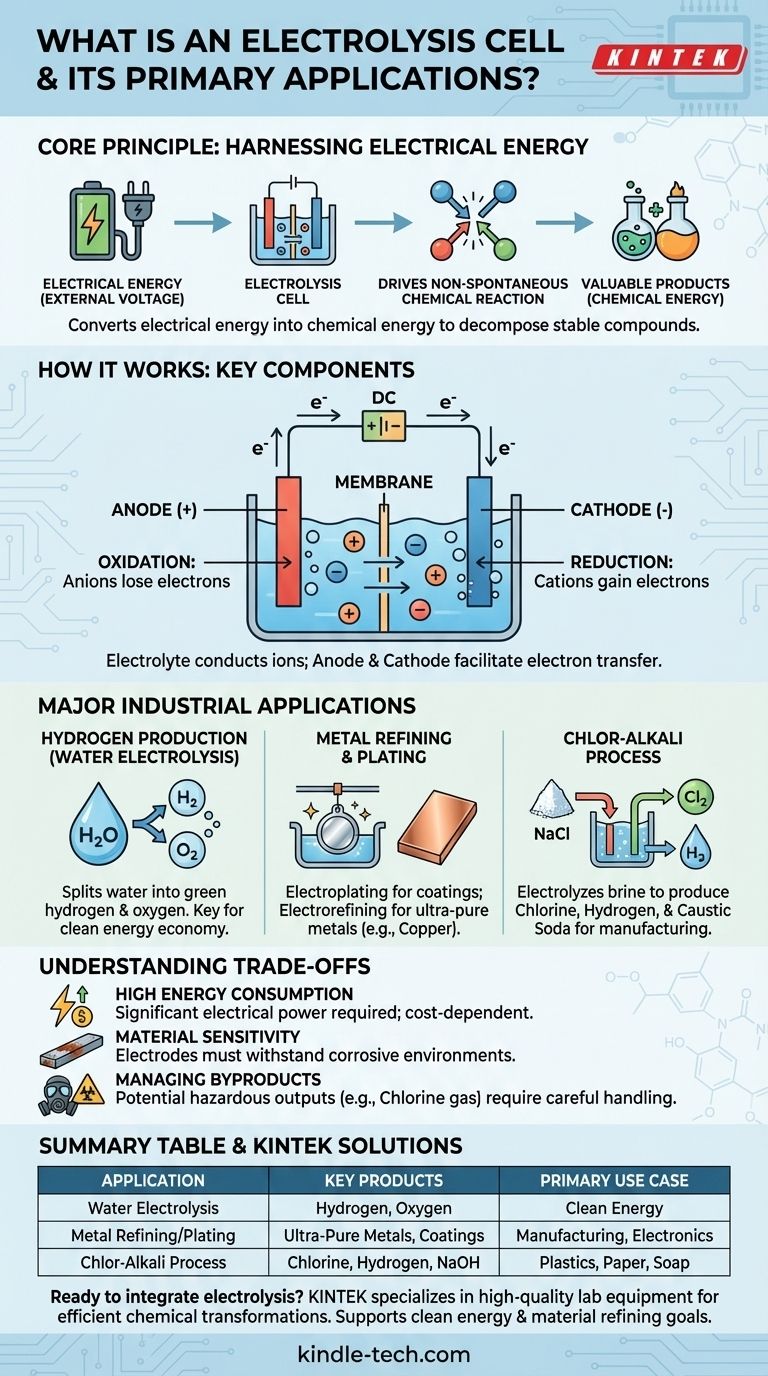
En esencia, una celda electrolítica es un dispositivo que aprovecha la energía eléctrica para impulsar una reacción química que de otro modo no ocurriría por sí sola. Funciona haciendo pasar una corriente eléctrica a través de una sustancia, típicamente una solución que contiene iones, para descomponerla o transformarla. Las aplicaciones industriales clave incluyen la producción de hidrógeno a partir de agua, el refinado de metales como el cobre y la fabricación de productos químicos esenciales como el cloro y el hidróxido de sodio.
Una celda electrolítica convierte fundamentalmente la energía eléctrica en energía química. Supera la estabilidad natural de los compuestos, utilizando la electricidad como herramienta para romperlos y crear sustancias nuevas, a menudo más valiosas.

Cómo funciona una celda electrolítica
Una celda electrolítica opera bajo el principio de la electrólisis, que literalmente significa "romper con electricidad". Este proceso es lo opuesto a lo que ocurre en una batería (una celda galvánica), que produce electricidad a partir de una reacción química espontánea.
El principio fundamental: forzar una reacción
Muchos compuestos químicos valiosos, como el agua (H₂O) o la sal (NaCl), son muy estables. No se descomponen espontáneamente en sus elementos constituyentes.
Una celda electrolítica proporciona la energía necesaria, en forma de un voltaje externo, para forzar que estas reacciones no espontáneas ocurran. Esta entrada de energía supera los enlaces químicos que mantienen unido el compuesto.
Componentes clave
Cada celda electrolítica tiene tres componentes principales:
- Ánodo: El electrodo positivo. En el ánodo, los iones cargados negativamente (aniones) pierden electrones en un proceso llamado oxidación.
- Cátodo: El electrodo negativo. En el cátodo, los iones cargados positivamente (cationes) ganan electrones en un proceso llamado reducción.
- Electrolito: Una sustancia (a menudo una solución) que contiene iones en movimiento libre. El electrolito conduce la electricidad y proporciona la materia prima para la reacción.
El tipo de electrodos y el electrolito específico utilizados se eligen cuidadosamente porque determinan directamente qué productos se formarán.
Principales aplicaciones industriales
La capacidad de controlar con precisión las transformaciones químicas con electricidad hace de la electrólisis un pilar de la industria moderna.
Producción de hidrógeno a partir de agua
Quizás la aplicación más discutida hoy en día es la electrólisis del agua. Al pasar una corriente a través del agua (que contiene un electrolito adecuado), la celda divide las moléculas de H₂O en sus componentes.
El gas oxígeno se forma en el ánodo, mientras que el gas hidrógeno puro se forma en el cátodo. Cuando la electricidad utilizada proviene de fuentes renovables, el producto resultante se denomina "hidrógeno verde", un componente clave en una futura economía de energía limpia.
Refinado y chapado de metales
La electrólisis es fundamental para producir y purificar metales. En la galvanoplastia, un objeto se coloca como cátodo en una celda que contiene iones del metal de recubrimiento deseado (como cromo o níquel). Los iones metálicos se reducen sobre el objeto, formando un recubrimiento delgado y duradero.
De manera similar, el electrorrefinado se utiliza para producir metales ultrapuros. Una losa impura de cobre, por ejemplo, se utiliza como ánodo. Cuando se aplica corriente, los átomos de cobre se disuelven en el electrolito, viajan al cátodo y se redepositan como cobre casi 100% puro, dejando las impurezas atrás.
El proceso cloro-álcali
Este proceso industrial masivo es uno de los usos más significativos de la electrólisis. Se electroliza una solución fuerte de cloruro de sodio (salmuera).
El resultado es la producción de tres productos químicos básicos de alto valor a partir de agua salada simple: gas cloro, gas hidrógeno y hidróxido de sodio (sosa cáustica). Estos son ingredientes fundamentales para la fabricación de plásticos, papel, jabones y miles de otros productos.
Comprendiendo las ventajas y desventajas
Aunque potente, la electrólisis no es una solución universal. Su aplicación implica consideraciones significativas.
Alto consumo de energía
El principal inconveniente de la electrólisis es su alto requerimiento energético. Forzar la ruptura de un compuesto estable requiere una cantidad sustancial de energía eléctrica, lo que puede encarecer el proceso. La viabilidad económica de un proceso electrolítico a menudo está directamente ligada al costo de la electricidad.
Sensibilidad del material y corrosión
Los electrodos mismos forman parte de un entorno químico activo. Deben ser capaces de soportar condiciones corrosivas y altas temperaturas sin degradarse o reaccionar de formas no deseadas. Elegir el material de electrodo adecuado es crucial para la eficiencia y la longevidad.
Gestión de subproductos
La electrólisis puede producir subproductos peligrosos o difíciles de manejar. Por ejemplo, en el proceso cloro-álcali, el gas cloro producido es tóxico y debe manejarse con extremo cuidado. El impacto ambiental general depende en gran medida tanto de la fuente de electricidad como del manejo seguro de todos los productos.
Tomar la decisión correcta para su objetivo
El diseño y la operación de una celda electrolítica se adaptan específicamente a su propósito previsto.
- Si su enfoque principal es producir metales de alta pureza: Su proceso se centrará en el electrorrefinado o la electroobtención, donde el control preciso del voltaje y la pureza del electrolito son primordiales para garantizar la calidad del producto.
- Si su enfoque principal es generar productos químicos básicos: Probablemente utilizará un modelo como el proceso cloro-álcali, que está optimizado para la producción continua a gran escala a partir de una materia prima económica como la salmuera.
- Si su enfoque principal es crear portadores de energía limpia: Sus esfuerzos implicarán la electrólisis del agua, donde la eficiencia de la celda y la integración con fuentes de energía renovables de bajo costo son los factores más críticos para el éxito.
Al aplicar energía eléctrica dirigida, una celda electrolítica transforma insumos básicos en productos de alto valor, lo que la convierte en una herramienta fundamental de la química y la industria modernas.
Tabla resumen:
| Aplicación | Productos clave | Caso de uso principal |
|---|---|---|
| Electrólisis del agua | Hidrógeno y gas oxígeno | Energía limpia (hidrógeno verde) |
| Refinado/chapado de metales | Metales ultrapuros, recubrimientos protectores | Fabricación, electrónica |
| Proceso cloro-álcali | Cloro, hidrógeno, hidróxido de sodio | Producción de plásticos, papel, jabón |
¿Listo para integrar la tecnología de electrólisis en su laboratorio o proceso industrial? KINTEK se especializa en equipos y consumibles de laboratorio de alta calidad, proporcionando las herramientas confiables que necesita para transformaciones químicas eficientes y precisas. Ya sea que esté desarrollando soluciones de energía limpia o refinando materiales, nuestra experiencia respalda sus objetivos. Contacte a nuestro equipo hoy para discutir cómo podemos mejorar sus operaciones.
Guía Visual
Productos relacionados
- Célula electrolítica electroquímica de cinco puertos
- Celda electrolítica electroquímica óptica de doble capa tipo H con baño de agua
- Celda Electrolítica Tipo H Triple Celda Electroquímica
- Celda Electrolítica Electroquímica para Evaluación de Recubrimientos
- Célula electrolítica de baño de agua de cinco puertos de doble capa
La gente también pregunta
- ¿Cuál es la forma correcta de manejar una celda electrolítica de baño de agua de cinco puertos? Asegure experimentos electroquímicos precisos y seguros
- ¿Cuáles son los componentes estándar de la celda electrolítica de baño de agua de cinco puertos? Domine el instrumento de precisión para el análisis electroquímico
- ¿Cómo se puede evitar la contaminación durante los experimentos con la celda electrolítica de baño de agua de cinco puertos? Domina el Protocolo de 3 Pilares
- ¿Qué precaución general se debe tomar al manipular la celda electrolítica? Asegure resultados de laboratorio seguros y precisos
- ¿Cómo se debe mantener el cuerpo de una celda electrolítica para su longevidad? Prolongue la vida útil de su equipo



















