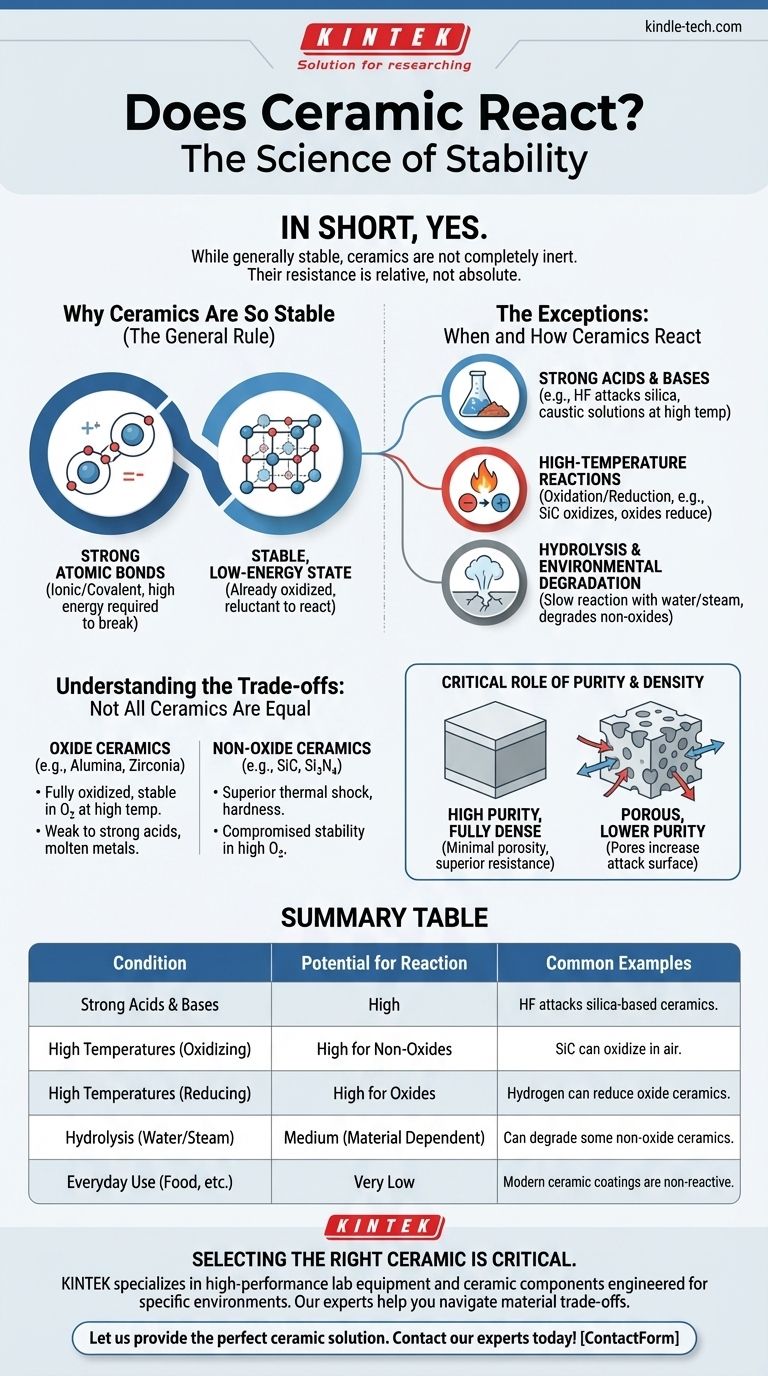
En resumen, sí. Aunque las cerámicas son famosas por su estabilidad química, no son completamente inertes. Bajo condiciones específicas que implican productos químicos agresivos, altas temperaturas o exposición ambiental prolongada, las cerámicas pueden y reaccionan.
El principio fundamental a entender es que la inercia de la cerámica es relativa, no absoluta. Su resistencia proviene de enlaces atómicos increíblemente fuertes, pero los productos químicos potentes o la energía extrema (como el calor elevado) pueden romper esos enlaces, a menudo a través de los mismos tipos de reacciones utilizadas para crear la cerámica en primer lugar.

Por qué las cerámicas son tan estables (la regla general)
Fuertes enlaces atómicos
La característica definitoria de un material cerámico son sus potentes enlaces atómicos. Estos son típicamente iónicos (los electrones se transfieren) o covalentes (los electrones se comparten).
Estos enlaces requieren una cantidad significativa de energía para romperse, razón por la cual las cerámicas generalmente exhiben alta dureza, altos puntos de fusión y excelente resistencia química en comparación con los metales o polímeros.
Un estado estable y de baja energía
La mayoría de las cerámicas comunes, como el óxido de aluminio o el dióxido de silicio, ya se encuentran en un estado oxidado altamente estable. Ya han reaccionado con el oxígeno y se han asentado en una configuración de baja energía, lo que las hace reacias a reaccionar más bajo condiciones normales.
Las excepciones: cuándo y cómo reaccionan las cerámicas
La estabilidad de una cerámica puede superarse. Las condiciones que causan una reacción suelen ser específicas y agresivas, dirigiéndose directamente a los enlaces atómicos que dan al material su fuerza.
Reacción con ácidos y bases fuertes
Ciertos ácidos y bases potentes pueden atacar químicamente las cerámicas. El ejemplo más conocido es el ácido fluorhídrico (HF), que es una de las pocas sustancias que pueden disolver cerámicas a base de sílice como el vidrio y el cuarzo.
Las soluciones alcalinas o cáusticas fuertes también pueden corroer lentamente algunas cerámicas de óxido, como el óxido de aluminio, especialmente a temperaturas elevadas.
Reacciones a alta temperatura (química redox)
Los procesos mencionados en la síntesis cerámica—oxidación y reducción—también pueden ser una fuente de degradación.
A temperaturas muy altas, una cerámica no óxido como el carburo de silicio (SiC) puede verse forzada a reaccionar con el oxígeno, convirtiéndola en dióxido de silicio (SiO₂) y monóxido de carbono. Por el contrario, una cerámica de óxido puede ser "reducida" si se calienta en presencia de un agente reductor fuerte como el hidrógeno o el carbono, despojando átomos de oxígeno de la cerámica.
Hidrólisis y degradación ambiental
Algunos tipos de cerámica, particularmente las cerámicas no óxido o aquellas con ciertas composiciones de límites de grano, pueden ser susceptibles a la hidrólisis.
Esta es una reacción lenta con agua o vapor, a menudo a altas temperaturas, que puede degradar las propiedades mecánicas del material con el tiempo. Esta es una consideración crítica para los componentes utilizados en turbinas o sistemas de energía geotérmica.
Comprendiendo las compensaciones: no todas las cerámicas son iguales
El término "cerámica" cubre una vasta familia de materiales. Su reactividad depende en gran medida de su química y estructura específicas.
Cerámicas de óxido vs. no óxido
Las cerámicas de óxido (por ejemplo, alúmina, zirconia) ya están completamente oxidadas. Esto las hace excepcionalmente estables en ambientes ricos en oxígeno, incluso a altas temperaturas. Su debilidad tiende a ser los ácidos muy fuertes o los metales fundidos.
Las cerámicas no óxido (por ejemplo, carburo de silicio, nitruro de silicio, nitruro de boro) ofrecen propiedades superiores en otras áreas, como la resistencia al choque térmico o la dureza. Sin embargo, su estabilidad se ve comprometida en atmósferas altamente oxidantes a temperaturas extremas, ya que pueden reaccionar con el oxígeno.
El papel crítico de la pureza y la densidad
El ataque químico a menudo comienza en los puntos débiles. En las cerámicas, estos puntos débiles son las impurezas y los límites entre los granos cristalinos.
Una cerámica de alta pureza, completamente densa y con porosidad mínima tendrá una resistencia química muy superior en comparación con una versión porosa y de menor pureza del mismo material. Los poros aumentan la superficie, dando a los productos químicos más oportunidades para atacar el material.
Tomando la decisión correcta para su aplicación
Elegir la cerámica adecuada requiere hacer coincidir las resistencias específicas del material con las demandas de su entorno.
- Si su enfoque principal es la máxima inercia química para material de laboratorio o uso médico: Seleccione una cerámica de óxido de alta pureza y completamente densa como la alúmina (Al₂O₃) o la zirconia estabilizada con itria (YSZ), pero siempre verifique su resistencia a sus agentes químicos específicos.
- Si su enfoque principal es el rendimiento a alta temperatura en el aire: Una cerámica de óxido es casi siempre la opción superior debido a su estabilidad inherente en atmósferas oxidantes.
- Si su enfoque principal es el rendimiento en un ambiente inerte o reductor de alta temperatura: Una cerámica no óxido como el carburo de silicio (SiC) o el nitruro de silicio (Si₃N₄) puede proporcionar un mejor rendimiento mecánico y estabilidad.
- Si su enfoque principal es el uso diario como utensilios de cocina: Los recubrimientos cerámicos modernos están diseñados para no reaccionar con todos los ácidos y bases alimentarios comunes y son excepcionalmente seguros para su propósito previsto.
Al comprender que la estabilidad de la cerámica es condicional, puede seleccionar el material preciso para garantizar el rendimiento, la seguridad y la longevidad en su aplicación específica.
Tabla resumen:
| Condición | Potencial de reacción | Ejemplos comunes |
|---|---|---|
| Ácidos y bases fuertes | Alto | El ácido fluorhídrico (HF) ataca las cerámicas a base de sílice. |
| Altas temperaturas (oxidantes) | Alto para no óxidos | El carburo de silicio (SiC) puede oxidarse en el aire. |
| Altas temperaturas (reductoras) | Alto para óxidos | El hidrógeno puede reducir las cerámicas de óxido. |
| Hidrólisis (agua/vapor) | Medio (depende del material) | Puede degradar algunas cerámicas no óxido con el tiempo. |
| Uso diario (alimentos, etc.) | Muy bajo | Los recubrimientos cerámicos modernos están diseñados para ser no reactivos. |
Seleccionar la cerámica adecuada es fundamental para el rendimiento y la seguridad de su aplicación. KINTEK se especializa en equipos y consumibles de laboratorio de alto rendimiento, incluidos componentes cerámicos diseñados para entornos químicos y térmicos específicos. Nuestros expertos pueden ayudarle a navegar por las compensaciones de materiales entre cerámicas de óxido y no óxido para garantizar la longevidad y la fiabilidad.
Permítanos proporcionarle la solución cerámica perfecta para las necesidades de su laboratorio. ¡Contacte hoy mismo a nuestros expertos para una consulta!
Guía Visual
Productos relacionados
- Lámina Cerámica de Carburo de Silicio (SiC) Resistente al Desgaste, Cerámica Avanzada Fina de Ingeniería
- Varilla de cerámica de alúmina fina avanzada de ingeniería Al2O3 aislada para aplicaciones industriales
- Junta aislante de cerámica de zirconio Ingeniería avanzada de cerámica fina
- Bola de cerámica de circonio mecanizada de precisión para cerámica fina avanzada de ingeniería
- Anillo Cerámico de Nitruro de Boro Hexagonal HBN
La gente también pregunta
- ¿Cuál es más duro, el carburo de silicio o el carburo de tungsteno? Descubra la clave para la selección de materiales
- ¿Cuál es la resistividad del carburo de silicio? Es una propiedad ajustable que varía desde <0.1 ohm-cm hasta muy resistiva.
- ¿Cuáles son las propiedades del SiC? Desbloquee el rendimiento a alta temperatura y alta frecuencia
- ¿El carburo de silicio es resistente al calor? Desbloquee un rendimiento superior en temperaturas extremas
- ¿Cuál es la resistencia a la temperatura del carburo de silicio? Soporta calor extremo hasta 1500°C



















