Índice de contenidos
Introducción a las pilas electroquímicas
Las pilas electroquímicas son el núcleo del almacenamiento y la conversión de energía. Aprovechan las reacciones químicas para generar electricidad o utilizan la electricidad para impulsar reacciones químicas. Estas células son componentes esenciales en diversos sistemas electroquímicos, como las baterías, las pilas de combustible y la galvanoplastia, y son vitales para los avances en las tecnologías energéticas, los vehículos eléctricos y la ingeniería electroquímica.
Tipos de pilas electroquímicas
Las pilas electroquímicas son dispositivos que convierten la energía química en energía eléctrica (pilas voltaicas) o viceversa (pilas electrolíticas). Constan de dos electrodos, un cátodo y un ánodo, sumergidos en una solución electrolítica.
Células voltaicas
También conocidas como células galvánicas, las células voltaicas generan electricidad a partir de reacciones químicas espontáneas. En una célula voltaica, el ánodo es el electrodo negativo donde se produce la oxidación, liberando electrones. Estos electrones fluyen a través de un circuito externo hasta el cátodo, el electrodo positivo, donde se produce la reducción. La naturaleza espontánea de la reacción impulsa el flujo de electrones y genera una corriente eléctrica.
Células electrolíticas
Las células electrolíticas, por su parte, utilizan la electricidad para impulsar reacciones químicas no espontáneas. En una célula electrolítica, el cátodo es el electrodo negativo donde se produce la reducción, y el ánodo es el electrodo positivo donde se produce la oxidación. Una fuente de energía externa proporciona la energía eléctrica necesaria para forzar la reacción no espontánea.
Diferencias clave
Las diferencias clave entre las pilas voltaicas y las electrolíticas son:
- Espontaneidad: Las células voltaicas generan electricidad a partir de reacciones espontáneas, mientras que las células electrolíticas requieren energía externa para impulsar reacciones no espontáneas.
- Dirección del flujo de electrones: En las células voltaicas, los electrones fluyen del ánodo al cátodo a través del circuito externo. En las células electrolíticas, los electrones fluyen del cátodo al ánodo a través del circuito externo.
- Aplicaciones: Las células voltaicas se utilizan en baterías, células solares y otros dispositivos que generan electricidad. Las células electrolíticas se utilizan en galvanoplastia, refinado de metales y otros procesos industriales.
Componentes de las células electroquímicas
Las células electroquímicas suelen constar de los siguientes componentes:
- Electrodos: El cátodo y el ánodo, hechos de materiales conductores (por ejemplo, metales, grafito).
- Electrolito: Una solución o sal fundida que conduce iones, permitiendo el flujo de corriente entre los electrodos.
- Separador: Barrera porosa que impide que los electrodos se toquen directamente pero permite el paso de iones.
Información adicional
- El potencial o voltaje de una célula electroquímica es una medida de la fuerza impulsora de la reacción. En las células voltaicas, el potencial de la célula es positivo, lo que indica una reacción espontánea. En las células electrolíticas, el potencial de la célula es negativo, lo que indica una reacción no espontánea.
- La eficacia de una célula electroquímica viene determinada por factores como los materiales de los electrodos, la concentración de electrolito y la temperatura.
- Las pilas electroquímicas desempeñan un papel crucial en diversas aplicaciones tecnológicas, como el almacenamiento de energía, la síntesis química y la recuperación del medio ambiente.
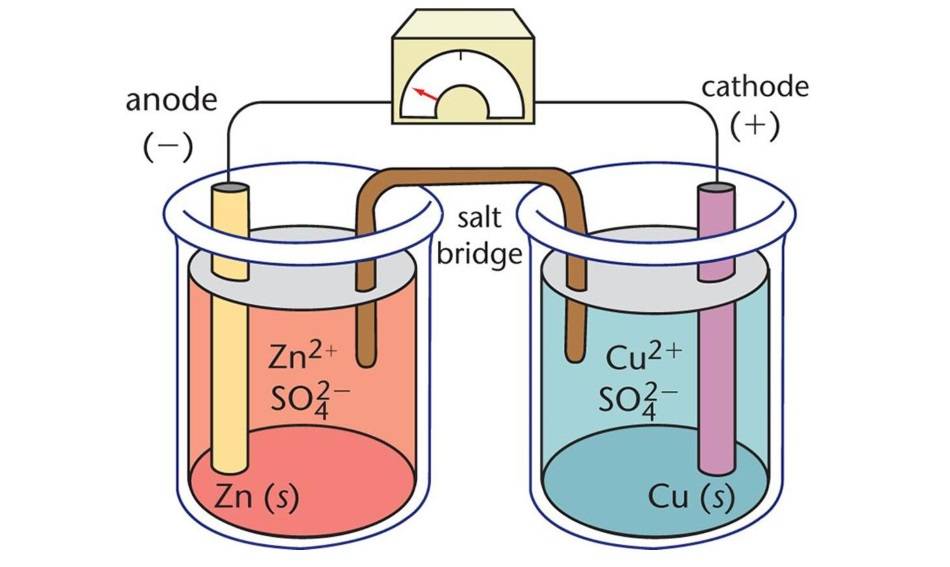
Componentes de las células electrolíticas
Las células electrolíticas, un tipo de célula electroquímica, son dispositivos que utilizan energía eléctrica para impulsar reacciones químicas no espontáneas. Constan de tres componentes principales: el ánodo, el cátodo y el electrolito.
Ánodo
El ánodo es el electrodo negativo de una célula electrolítica. Durante la reacción electroquímica, el ánodo libera electrones al circuito externo y sufre una oxidación. En otras palabras, en el ánodo se produce la pérdida de electrones y la oxidación.
Cátodo
El cátodo, por su parte, actúa como electrodo positivo. Adquiere electrones del circuito externo y se reduce durante la reacción electroquímica. Por lo tanto, en el cátodo se produce la ganancia de electrones y la reducción.
Electrolito
El electrolito es una sustancia que contiene iones móviles cuando se disuelve en un disolvente o se funde. En las células electrolíticas, el electrolito proporciona un medio para el flujo de iones entre el ánodo y el cátodo, completando el circuito eléctrico. Los electrolitos más comunes son las soluciones acuosas de sales y las sales fundidas.
Principales diferencias con las células galvánicas
Las células electrolíticas difieren de las células galvánicas en varios aspectos clave:
- Reacciones celulares: Las células electrolíticas requieren una fuente externa de energía eléctrica para impulsar reacciones no espontáneas, mientras que las células galvánicas generan energía eléctrica a partir de reacciones espontáneas.
- Flujo de energía: Las células electrolíticas consumen energía eléctrica para impulsar reacciones no espontáneas, mientras que las células galvánicas convierten la energía química en energía eléctrica.
- Cargas de los electrodos: En las células electrolíticas, el ánodo es negativo y el cátodo positivo, mientras que en las células galvánicas, el ánodo es positivo y el cátodo negativo.
Funcionamiento de una célula electrolítica
El funcionamiento de una célula electrolítica implica los siguientes pasos:
- Una fuente de energía externa (por ejemplo, una batería) se conecta a los electrodos de la célula electrolítica.
- La fuente de alimentación proporciona energía eléctrica, que impulsa la reacción no espontánea.
- En el ánodo se produce la oxidación, que libera electrones al circuito externo.
- Los electrones fluyen a través del circuito externo hasta el cátodo.
- En el cátodo se produce la reducción, que consume electrones del circuito externo.
- Los iones del electrolito migran para mantener la neutralidad eléctrica, completando el circuito.
Aplicaciones de las células electrolíticas
Las células electrolíticas tienen numerosas aplicaciones prácticas, entre las que se incluyen:
- Galvanoplastia: Depósito de una fina capa de metal sobre una superficie con fines decorativos o de protección.
- Electrólisis del agua: Producción de hidrógeno y oxígeno a partir del agua, que se utiliza en pilas de combustible y otras aplicaciones.
- Producción de sustancias químicas: Sintetizar diversos productos químicos, como cloro, hidróxido de sodio y aluminio.
- Refinado de metales: Purificación de metales mediante la eliminación de impurezas por electrólisis.

Potenciales de electrodo y reacciones redox
Las células electroquímicas facilitan las reacciones de oxidación-reducción (redox). Estas células se presentan en dos formas: células galvánicas (voltaicas), en las que se producen reacciones espontáneas, y células electrolíticas, en las que tienen lugar reacciones no espontáneas.
En las células electroquímicas, la reacción de oxidación tiene lugar en el ánodo (terminal negativo), mientras que la reacción de reducción se produce en el cátodo (terminal positivo). En las células electrolíticas, el ánodo atrae los aniones, por lo que es positivo, mientras que en las células galvánicas, el ánodo es negativo debido a la liberación de electrones de la reacción de oxidación espontánea.
La dirección del flujo de electrones y la espontaneidad de las reacciones redox vienen determinadas por el potencial de electrodo, que es la diferencia de potencial entre los electrodos. El electrodo de hidrógeno estándar (SHE) sirve como punto de referencia, con una tensión de 0 voltios.
El potencial de la célula, que puede predecirse utilizando los potenciales de electrodo, proporciona una estimación del potencial medido. Para calcular el potencial de la célula, hay que equilibrar las ecuaciones de reacción de la semicélula y determinar la diferencia de tensión entre los potenciales de los electrodos.
El cátodo y el ánodo desempeñan papeles distintos en las células electroquímicas:
Cátodo:
- Signo positivo debido al consumo de electrones
- Se produce la reacción de reducción
- Entran electrones
Ánodo:
- Signo negativo debido a la liberación de electrones
- Se produce la reacción de oxidación
- Los electrones salen
Por convención, el cátodo se representa en el lado derecho, mientras que el ánodo está en el lado izquierdo cuando se denota una célula electroquímica.
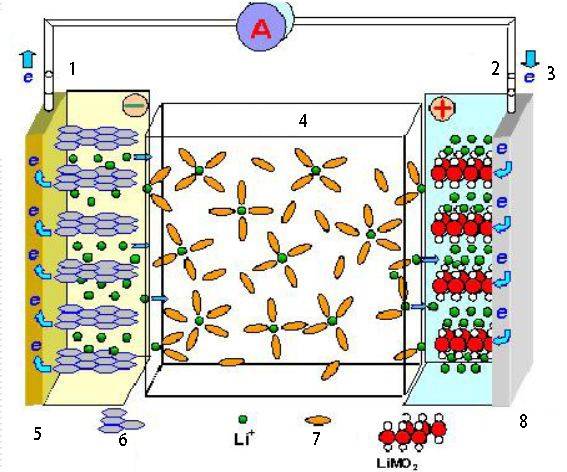
Aplicaciones de las pilas electroquímicas
Las pilas electroquímicas tienen una amplia gama de aplicaciones en diversos campos, como el almacenamiento de energía, la conversión y los procesos industriales.
Galvanoplastia
La galvanoplastia es un proceso que utiliza células electroquímicas para aplicar una fina capa de metal a la superficie de otro metal. Este proceso mejora las propiedades del metal base, como la resistencia a la corrosión, a la abrasión y al desgaste. La galvanoplastia se utiliza ampliamente en sectores como la automoción, la electrónica y la joyería, tanto con fines funcionales como estéticos.
Baterías
Las pilas electroquímicas son la base de las baterías, componentes esenciales de numerosos aparatos electrónicos y electrodomésticos. Las pilas almacenan energía química y la convierten en energía eléctrica cuando es necesario. Son vitales para alimentar dispositivos portátiles, como teléfonos inteligentes, ordenadores portátiles y vehículos eléctricos.
Electrowinning y Electrorefining
Las pilas electroquímicas se emplean en los procesos de electroobtención y electrorrefinado para producir y purificar metales. La electroobtención consiste en extraer metales de minerales u otras fuentes mediante electrólisis, mientras que el electrorrefinado purifica aún más los metales eliminando impurezas. Estos procesos son cruciales para obtener metales de gran pureza, como cobre, zinc y aluminio, esenciales para diversas aplicaciones industriales.
Otras aplicaciones
Las células electroquímicas también tienen aplicaciones en otros ámbitos:
- Tratamiento de aguas: Se utilizan en la electrólisis del agua para producir gas hidrógeno y gas oxígeno, que son vitales para las pilas de combustible y otros procesos industriales.
- Pilas de combustible: Las pilas electroquímicas son los componentes principales de las pilas de combustible, que generan electricidad mediante reacciones electroquímicas en las que intervienen hidrógeno y oxígeno.
- Síntesis química: Las pilas electroquímicas pueden utilizarse en procesos de síntesis química para producir diversos productos químicos y materiales.
- Sensores y biosensores: Las células electroquímicas se utilizan en sensores y biosensores para detectar y analizar sustancias específicas en función de sus propiedades electroquímicas.

Conclusión
Las células electroquímicasgracias a su capacidad para convertir la energía química en energía eléctrica y viceversa, son herramientas indispensables en diversos campos. Sirven de base para el almacenamiento y la conversión de energía, así como para numerosos procesos industriales. Desde las baterías que alimentan nuestros dispositivos hasta las pilas de combustible que generan energía limpia, las células electroquímicas siguen dando forma a los avances tecnológicos. Comprender sus principios y aplicaciones es fundamental para seguir innovando en tecnologías energéticas, soluciones sostenibles e ingeniería electroquímica.
Productos relacionados
- Celda Electrolítica Tipo H Triple Celda Electroquímica
- Celda de gas de difusión electrolítica electroquímica Celda de reacción de flujo de líquido
- Celda Electrolítica Electroquímica para Evaluación de Recubrimientos
- Celda electrolítica electroquímica óptica de ventana lateral
- Celda electroquímica electrolítica de cuarzo para experimentos electroquímicos
Artículos relacionados
- Comprender las celdas electrolíticas de cuarzo: Aplicaciones, mecanismos y ventajas
- Superación de desafíos con el funcionamiento de celdas electrolíticas tipo H
- Aplicaciones de la celda electrolítica tipo H en la extracción de metales
- El Diálogo Silencioso: Dominando el Control en Celdas Electrolíticas
- Electroquímica La ciencia detrás de las celdas electroquímicas




















