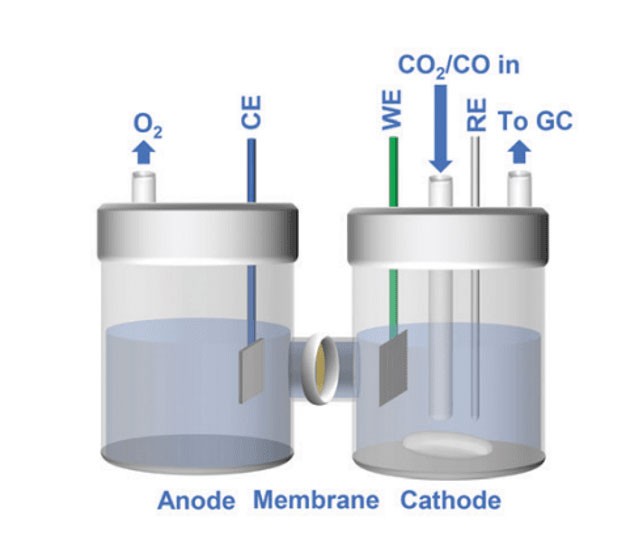
Introducción a las células electrolíticas de cuarzo
Las celdas electrolíticas de cuarzo son fundamentales para transformar la energía eléctrica en energía química, desempeñando un papel crucial en diversos procesos industriales. Estas células se caracterizan por el uso del cuarzo como material clave, que no sólo resiste altas temperaturas sino que también mantiene su inercia química. En su núcleo, las celdas electrolíticas de cuarzo constan de electrodos y electrolitos, que juntos facilitan reacciones precisas de oxidación y reducción. Esta introducción sienta las bases para una exploración más profunda de los mecanismos, aplicaciones y ventajas de las celdas electrolíticas de cuarzo, destacando su importancia en industrias que van desde la producción de metales hasta la farmacéutica.
Mecanismo de acción de las celdas electrolíticas de cuarzo
Las celdas electrolíticas de cuarzo son dispositivos especializados que se utilizan en diversos procesos industriales, en particular en la electrorrefinación y la electroobtención de metales no férreos como el aluminio, el cobre, el zinc y el plomo. Estas celdas están diseñadas para facilitar la migración de iones y la conducción eficaz de las reacciones de oxidación y reducción mediante el uso de una estructura de cuarzo y un medio electrolítico cuidadosamente elegido.
Migración de iones y funciones de los electrodos
En una célula electrolítica de cuarzo, el proceso comienza cuando se aplica una tensión externa al sistema. Este voltaje impulsa la migración de iones dentro del electrolito. Los iones positivos, o cationes, son atraídos hacia el cátodo cargado negativamente, mientras que los iones negativos, o aniones, se mueven hacia el ánodo cargado positivamente. Este movimiento de los iones es crucial para la conducción de la electricidad y el inicio de las reacciones químicas.
En el cátodo se producen las reacciones de reducción. Aquí, los cationes ganan electrones y se depositan en la superficie del cátodo. Por ejemplo, en la electrorrefinación del cobre, los iones de cobre (Cu²⁺) ganan electrones para formar cobre metálico puro, que se deposita en el cátodo. Este proceso es esencial para obtener metales de gran pureza utilizados en diversas aplicaciones industriales.
Por el contrario, en el ánodo se producen reacciones de oxidación. Los aniones pierden electrones y liberan otros iones o moléculas. En el caso de la electrorrefinería de cobre, el ánodo está hecho de cobre impuro. A medida que el cobre se disuelve, libera impurezas en el electrolito, que se eliminan, dejando cobre puro en el cátodo.

Importancia del medio electrolítico
El medio electrolítico en una célula electrolítica de cuarzo desempeña un papel fundamental en la eficiencia y eficacia de las reacciones. El electrolito debe ser un buen conductor de iones y debe ser estable en las condiciones de la reacción. Los electrolitos comunes incluyen soluciones acuosas de sales, ácidos o bases, así como sales fundidas.
La elección del electrolito depende de los requisitos específicos de la reacción, como el pH deseado, la concentración de iones y la temperatura a la que se produce la reacción. Por ejemplo, en la producción de aluminio de alta pureza, se utiliza como electrolito una mezcla fundida de criolita (Na₃AlF₆) y alúmina (Al₂O₃). Esta mezcla tiene un punto de fusión bajo y es altamente conductora, lo que la hace ideal para la reducción electrolítica de alúmina a aluminio.
La estructura del cuarzo y sus ventajas
El uso de cuarzo en celdas electrolíticas ofrece varias ventajas. El cuarzo es un excelente aislante, lo que ayuda a mantener la integridad del campo eléctrico dentro de la célula. Además, el cuarzo es resistente a la corrosión química, lo que garantiza que la célula pueda funcionar en condiciones adversas sin degradarse.
La estructura de cuarzo también permite controlar con precisión la distribución de iones y el flujo de electricidad. Esta precisión es crucial para optimizar la eficacia de las reacciones y minimizar las pérdidas de energía. Además, la transparencia del cuarzo permite el seguimiento visual de las reacciones, lo que resulta beneficioso para el control del proceso y la resolución de problemas.
Aplicaciones en purificación de metales y galvanoplastia
Las celdas electrolíticas de cuarzo se utilizan ampliamente en la purificación de metales y en los procesos de galvanoplastia. En la purificación de metales, como la electrorrefinación del cobre, el metal impuro se utiliza como ánodo y en el cátodo se deposita un metal puro. Este proceso elimina las impurezas y da como resultado un metal de gran pureza apto para diversas aplicaciones industriales.
En galvanoplastia, se utilizan celdas electrolíticas de cuarzo para depositar una fina capa del metal deseado sobre un sustrato. Este proceso mejora las propiedades del sustrato, como su aspecto, durabilidad y resistencia a la corrosión. La galvanoplastia se utiliza habitualmente en la industria automovilística, aeroespacial y electrónica.
Conclusión
En resumen, las celdas electrolíticas de cuarzo son herramientas esenciales en la producción de metales de gran pureza y en diversos procesos electroquímicos. Su mecanismo de acción implica la migración de iones, el papel de los electrodos para facilitar las reacciones de oxidación y reducción y la importancia del medio electrolítico. El uso del cuarzo ofrece varias ventajas, como el aislamiento, la resistencia a la corrosión y el control preciso de las reacciones. Estas células se utilizan ampliamente en la purificación de metales y la galvanoplastia, contribuyendo al avance de diversas aplicaciones industriales.
Aplicaciones de las celdas electrolíticas de cuarzo
Las celdas electrolíticas de cuarzo desempeñan un papel crucial en diversas aplicaciones industriales, especialmente en la producción de metales de gran pureza, la electrólisis del agua y la industria farmacéutica. Estas células están diseñadas para soportar altas temperaturas y entornos corrosivos, por lo que son ideales para procesos que requieren precisión y fiabilidad.
Producción de metales de gran pureza
Una de las principales aplicaciones de las células electrolíticas de cuarzo es la producción de metales de gran pureza, como el aluminio y el cobre. El proceso electrolítico implica el uso de una corriente continua para impulsar una reacción química no espontánea. En el caso de la producción de aluminio, la materia prima, la bauxita, se disuelve en un baño de criolita fundida. A continuación, los iones de aluminio se reducen en el cátodo, dando lugar a la deposición de aluminio puro. Este proceso consume mucha energía, pero garantiza un nivel de pureza de hasta el 99,99%.
Del mismo modo, el cobre de alta pureza se produce mediante un proceso conocido como electrorrefinado. En este proceso, se utiliza cobre impuro como ánodo y, al pasar la corriente por la célula electrolítica, se depositan iones de cobre puro en el cátodo. Las impurezas permanecen en el electrolito o forman un lodo separado en el fondo de la célula, lo que garantiza la pureza del producto final.
Electrólisis del agua
Las células electrolíticas de cuarzo también se utilizan ampliamente en la electrólisis del agua, un proceso que divide el agua en sus elementos constitutivos, hidrógeno y oxígeno. Este proceso es especialmente útil en industrias que requieren grandes cantidades de estos gases, como la química y la farmacéutica. La electrólisis del agua consiste en hacer pasar una corriente eléctrica a través de agua que contiene iones disueltos (normalmente procedentes de una sal o un ácido). Los iones de hidrógeno (H+) migran al cátodo, donde se reducen a hidrógeno gaseoso, mientras que los iones de hidróxido (OH-) migran al ánodo, donde se oxidan a oxígeno gaseoso.

Industria farmacéutica
En la industria farmacéutica, las celdas electrolíticas de cuarzo se utilizan en la producción de diversos productos químicos y compuestos. Por ejemplo, la electrólisis de una solución de cloruro sódico (salmuera) se utiliza para producir cloro gaseoso e hidróxido sódico (sosa cáustica), materias primas esenciales en la síntesis de muchos productos farmacéuticos. El control preciso del proceso electrolítico que proporcionan las celdas de cuarzo garantiza la alta pureza y consistencia de estos productos químicos, que son fundamentales para las aplicaciones farmacéuticas.
Galvanoplastia y tratamiento de superficies
Otra aplicación importante de las células electrolíticas de cuarzo son los procesos de galvanoplastia y tratamiento de superficies. La galvanoplastia consiste en depositar una fina capa de un metal específico sobre la superficie de otro metal para mejorar sus propiedades, como la resistencia a la corrosión, la resistencia al desgaste o el atractivo estético. Las células de cuarzo proporcionan un entorno estable y controlado para estos procesos, garantizando revestimientos uniformes y de alta calidad.
Consumo energético y eficiencia
El consumo de energía en los procesos electrolíticos varía en función del metal que se produzca. Por ejemplo, la producción electrolítica de aluminio requiere aproximadamente 13-15 kWh de electricidad por kilogramo de metal. En cambio, el refinado del cobre mediante electrólisis consume entre 150 y 300 kWh por tonelada de cobre refinado. A pesar de los elevados requisitos energéticos, la eficacia y pureza de los productos finales hacen que estos procesos sean indispensables en la industria moderna.
En conclusión, las celdas electrolíticas de cuarzo son vitales en diversos sectores industriales, ya que ofrecen un control preciso y una gran eficacia en la producción de metales de gran pureza, la electrólisis del agua y los productos químicos farmacéuticos. Su capacidad para funcionar en entornos difíciles y su durabilidad las convierten en una herramienta esencial en las industrias modernas de fabricación y procesamiento.
Ventajas del uso de cuarzo en celdas electrolíticas
El cuarzo, una forma de sílice (SiO2), es conocido por sus propiedades únicas que lo convierten en un material ideal para su uso en celdas electrolíticas. Estas células son cruciales en diversos procesos industriales, como la producción de productos químicos, metales y semiconductores. La elección del cuarzo frente a otros materiales como el vidrio se debe principalmente a su mayor resistencia a las altas temperaturas, su inercia química y sus excelentes propiedades eléctricas.
Resistencia a altas temperaturas
El cuarzo puede soportar temperaturas de hasta 1100°C, significativamente superiores a las del vidrio, que se ablanda a unos 700°C. Esta resistencia a altas temperaturas es vital en las celdas electrolíticas, donde las temperaturas pueden aumentar considerablemente debido a las corrientes eléctricas y las reacciones químicas implicadas. La capacidad del cuarzo para mantener su integridad estructural en tales condiciones garantiza la longevidad y eficacia del proceso electrolítico.
Inercia química
El cuarzo es muy resistente a la mayoría de los productos químicos, incluidos ácidos, álcalis y sales. Esta inercia química es especialmente beneficiosa en las celdas electrolíticas, donde el entorno suele ser muy corrosivo debido a los electrolitos utilizados. Al utilizar cuarzo, se minimiza el riesgo de reacciones químicas que podrían degradar los componentes de la célula, lo que aumenta su durabilidad y rendimiento.

Propiedades eléctricas
A diferencia del vidrio, que es un buen aislante, el cuarzo es un excelente conductor de la electricidad. Esta propiedad es crucial en las celdas electrolíticas, donde la conducción eficaz de la electricidad es esencial para que el proceso electrolítico se produzca con eficacia. La elevada rigidez dieléctrica del cuarzo y sus bajas pérdidas eléctricas lo convierten en un material ideal para los electrodos y otros componentes eléctricos de la célula.
Pureza y transparencia
El cuarzo es altamente puro, con un contenido de SiO2 de al menos el 99,9%. Esta elevada pureza es esencial en industrias como la de fabricación de semiconductores, donde incluso pequeñas cantidades de impurezas pueden afectar negativamente al proceso. La transparencia del cuarzo desde el espectro ultravioleta al infrarrojo también permite una mejor supervisión y control del proceso electrolítico, garantizando unos resultados de mayor calidad.
Propiedades mecánicas y ópticas
El cuarzo presenta unas propiedades mecánicas excepcionales, como una gran rigidez, elasticidad y resistencia a los golpes. Estas propiedades garantizan que los componentes de cuarzo puedan soportar las tensiones mecánicas que se producen en las celdas electrolíticas sin comprometer su integridad estructural. Además, las excelentes propiedades de transmisión óptica del cuarzo permiten una supervisión y un ajuste precisos del proceso electrolítico, lo que contribuye a una mayor eficacia y precisión.
Aplicaciones en celdas electrolíticas
Las propiedades únicas del cuarzo lo hacen adecuado para una amplia gama de aplicaciones en celdas electrolíticas. Los tubos y varillas de cuarzo, por ejemplo, se utilizan en la fabricación de semiconductores para la limpieza de baños tras el grabado y el mecanizado, y en tubos sometidos a tratamientos térmicos. En los laboratorios, el cuarzo se utiliza en mirillas, ópticas y diversos procesos industriales en los que su resistencia a los golpes y su inercia química son inestimables.
En conclusión, el uso del cuarzo en celdas electrolíticas aprovecha sus propiedades superiores, como la resistencia a altas temperaturas, la inercia química, las excelentes propiedades eléctricas y las ventajas mecánicas y ópticas. Estas características no sólo mejoran el rendimiento y la longevidad de las células electrolíticas, sino que también contribuyen a la producción de productos de alta calidad en diversas aplicaciones industriales.
Comparación con otros tipos de células electrolíticas
Las células electrolíticas son un tipo fundamental de célula electroquímica, que difiere significativamente de las células galvánicas en su configuración, funcionamiento y usos típicos. Comprender estas diferencias es crucial para seleccionar el tipo de célula apropiado para aplicaciones específicas en investigación e industria.
Principales diferencias entre las células electrolíticas y las galvánicas
-
Conversión de energía:
- Células galvánicas: Estas células convierten la energía química en energía eléctrica de forma espontánea. Son impulsadas por reacciones redox que se producen de forma natural, produciendo un flujo de electrones del ánodo al cátodo a través de un circuito externo. Algunos ejemplos son las baterías y las pilas de combustible.
- Células electrolíticas: Por el contrario, las células electrolíticas requieren una fuente de energía eléctrica externa para impulsar reacciones químicas no espontáneas. Se utilizan en procesos como la electrólisis, donde la energía eléctrica se utiliza para descomponer compuestos o impulsar reacciones en una dirección deseada.
-
Espontaneidad de las reacciones:
- Células galvánicas: Las reacciones en las células galvánicas son espontáneas, lo que significa que se producen sin necesidad de una fuente de energía externa una vez que la célula está configurada.
- Células electrolíticas: Las reacciones en las células electrolíticas no son espontáneas y requieren la entrada de energía eléctrica para llevarse a cabo.
-
Polaridades de los electrodos:
- Células galvánicas: En las células galvánicas, el ánodo es el electrodo negativo donde se produce la oxidación, y el cátodo es el electrodo positivo donde se produce la reducción.
- Células electrolíticas: Las polaridades se invierten en las células electrolíticas. El ánodo es positivo y el cátodo negativo, lo que refleja la necesidad de una fuente de energía externa para forzar a los electrones en contra de su flujo natural.

Usos típicos de las células electrolíticas y galvánicas
- Células galvánicas: De uso común en dispositivos cotidianos como pilas (por ejemplo, alcalinas, de iones de litio), pilas de combustible y células solares. Son esenciales para los dispositivos electrónicos portátiles, ya que proporcionan una fuente fiable de energía eléctrica mediante reacciones químicas espontáneas.
- Pilas electrolíticas: Se utilizan en procesos industriales como la galvanoplastia (recubrimiento de un metal sobre otro), la electrólisis del agua (producción de hidrógeno y oxígeno) y el refinado de metales (por ejemplo, el refinado del cobre). También son cruciales en la producción de productos químicos como el hidróxido de sodio y el cloro mediante la electrólisis de la salmuera.
Diferencias estructurales
- Células galvánicas: Consisten normalmente en dos soluciones electrolíticas diferentes en recipientes separados, conectadas por un puente de sal para mantener la neutralidad eléctrica. Los electrodos (ánodo y cátodo) se sumergen en estas soluciones, y un circuito externo permite el flujo de electrones.
- Células electrolíticas: Suelen tener una estructura más sencilla, con los dos electrodos sumergidos en una única solución electrolítica. La fuente de energía externa se conecta a los electrodos para impulsar el proceso electrolítico.
Conclusión
Aunque tanto las pilas electrolíticas como las galvánicas son tipos de pilas electroquímicas e implican reacciones redox, tienen finalidades fundamentalmente diferentes debido a la naturaleza de sus reacciones y a las conversiones de energía que facilitan. Comprender estas diferencias ayuda a seleccionar el tipo de célula adecuado para aplicaciones específicas, ya sea para generar energía eléctrica espontáneamente o para impulsar reacciones químicas mediante la entrada de energía eléctrica.
Conclusión
En conclusión,las células electrolíticas de cuarzo destacan como componentes críticos en los procesos industriales modernos, aprovechando sus propiedades únicas para facilitar reacciones químicas precisas y la producción de metales de gran pureza. Su capacidad para soportar altas temperaturas y su inercia química las sitúan como alternativas superiores en diversas aplicaciones, desde la electrólisis del agua hasta la producción farmacéutica. A pesar de problemas como el mantenimiento y la degradación de los electrodos, la investigación en curso promete innovaciones que mejorarán su eficacia y ampliarán su utilidad. A medida que las industrias sigan evolucionando, el papel de las celdas electrolíticas de cuarzo crecerá sin duda, subrayando su importancia en el avance de los procesos tecnológicos y químicos.
Productos relacionados
- Celda electroquímica electrolítica de cuarzo para experimentos electroquímicos
- Celda electrolítica electroquímica óptica de ventana lateral
- Celda Electrolítica Tipo H Triple Celda Electroquímica
- Bañera de agua para celda electrolítica electroquímica multifuncional de una o dos capas
- Celda electrolítica electroquímica óptica de doble capa tipo H con baño de agua
Artículos relacionados
- La Geometría del Control: Por Qué los Milímetros Importan en la Electroquímica
- La Variable Invisible: Por Qué Los Rituales Post-Experimento Definen la Verdad Científica
- El Recipiente de la Verdad: Por qué el Contenedor Importa Más que la Química
- El Corazón de Vidrio del Experimento: Precisión a Través del Cuidado Sistemático
- El Diálogo Silencioso: Dominando el Control en Celdas Electrolíticas