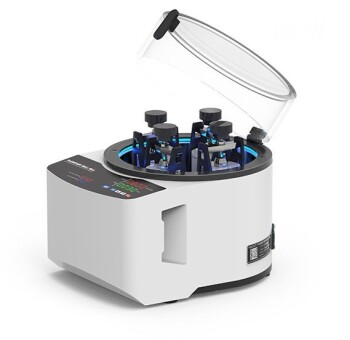
En la industria farmacéutica, la liofilización es el método definitivo para preservar la integridad y prolongar la vida útil de los fármacos sensibles. Este proceso, también conocido como liofilización, es fundamental para la fabricación de vacunas, antibióticos, proteínas y otros medicamentos de base biológica estables que, de otro modo, se degradarían rápidamente, asegurando que sigan siendo eficaces desde la producción hasta la administración al paciente.
El desafío principal para muchos medicamentos avanzados es su inestabilidad inherente en forma líquida. La liofilización resuelve esto eliminando el agua a bajas temperaturas, deteniendo eficazmente la degradación y fijando la estructura molecular del fármaco en un estado sólido y estable para su almacenamiento y transporte a largo plazo.

El problema fundamental: la inestabilidad de los fármacos
Muchos de los tratamientos más potentes de la medicina moderna son también los más frágiles. Los productos biológicos, en particular, presentan un desafío significativo en cuanto a su conservación.
Por qué el calor y la humedad son enemigos
Los ingredientes farmacéuticos activos (API), especialmente las moléculas grandes como las proteínas y las enzimas, son altamente susceptibles a la degradación química y física.
Cuando se disuelven en agua, estas moléculas pueden reaccionar, agruparse (agregarse) o descomponerse, perdiendo su función terapéutica. El calor acelera drásticamente este proceso.
La fragilidad de los productos biológicos
Las vacunas, las proteínas terapéuticas y las enzimas derivan su función de una forma tridimensional precisa y compleja.
Incluso un calor moderado puede hacer que estas moléculas se "desnaturalicen" o se desplieguen, destruyendo permanentemente su eficacia. Esto hace que los métodos de secado convencionales basados en el calor sean completamente inadecuados.
Cómo la liofilización preserva la eficacia
La liofilización es una solución elegante que evita los efectos dañinos del calor y la degradación en estado líquido. Es un proceso de tres pasos que implica la congelación, una fase de secado primario al vacío y una fase de secado secundario.
El principio de la sublimación
El principio fundamental de la liofilización es la sublimación: la transición de una sustancia directamente de un sólido (hielo) a un gas (vapor de agua) sin pasar por una fase líquida.
Al congelar el producto y luego aplicar un vacío profundo, las moléculas de agua se eliminan suavemente. Esto evita el estrés estructural y las reacciones químicas que ocurren en estado líquido.
Fijación de la estructura molecular
El proceso crea eficazmente un "andamio" estable de las moléculas del fármaco, fijándolas en su orientación correcta. El producto final es un pastel seco y poroso conocido como liofilizado.
Esta forma de estado sólido previene la movilidad molecular, deteniendo las vías de degradación que hacen que las formulaciones líquidas sean inútiles con el tiempo.
Prolongación de la vida útil de días a años
Un producto biológico líquido podría ser estable solo durante días o semanas, incluso bajo refrigeración.
Una vez liofilizado correctamente, el mismo producto puede permanecer estable durante varios años a temperatura ambiente o refrigerada, un factor crítico para gestionar el inventario y garantizar el acceso global.
Aplicaciones críticas a lo largo del ciclo de vida del fármaco
La liofilización no es solo un paso de fabricación; es una tecnología habilitadora utilizada desde las primeras etapas de la investigación hasta el producto comercial final.
En investigación y desarrollo (I+D)
Los científicos utilizan liofilizadores a escala de laboratorio para estabilizar nuevos candidatos a fármacos y muestras biológicas preciosas. Esto garantiza que los resultados de la investigación sean consistentes y que los nuevos compuestos puedan estudiarse con el tiempo sin degradarse.
Para ensayos clínicos
La producción de fármacos de investigación estables es esencial para los ensayos clínicos. La liofilización permite fabricar y enviar un producto consistente a los centros de ensayo de todo el mundo, asegurando que todos los participantes reciban la misma dosis y formulación.
En la fabricación comercial
A gran escala, la liofilización se utiliza para crear productos comerciales finales. Esto incluye una amplia gama de inyectables, vacunas e incluso kits de diagnóstico portátiles que requieren enzimas estables para funcionar correctamente en el campo.
Las ventajas prácticas de los productos liofilizados
Más allá de la estabilidad, los fármacos liofilizados ofrecen importantes beneficios logísticos y clínicos.
Almacenamiento y transporte simplificados
Los polvos liofilizados son ligeros y mucho menos sensibles a las fluctuaciones de temperatura que sus contrapartes líquidas. Esto reduce drásticamente la dependencia de una "cadena de frío" estricta y costosa para el envío y el almacenamiento.
Este beneficio es particularmente crucial para distribuir vacunas y medicamentos a regiones remotas o en desarrollo donde no se garantiza una refrigeración constante.
Reconstitución rápida para uso del paciente
La estructura de pastel poroso creada por la liofilización permite que el producto se reconstituya rápidamente.
Antes de la administración, un profesional de la salud puede disolver rápidamente el polvo con un líquido estéril (como agua estéril), asegurando que el paciente reciba el medicamento en su forma completamente activa.
Comprender las compensaciones
Aunque indispensable, la liofilización es un proceso complejo y que requiere muchos recursos, con desafíos específicos.
Costo y duración del proceso
La liofilización es un proceso lento, basado en lotes, que puede tardar varios días en completarse. El equipo especializado y el alto consumo de energía lo convierten en una de las operaciones unitarias más caras en la fabricación farmacéutica.
Requisito de procesamiento aséptico
Debido a que muchos fármacos liofilizados son inyectables, todo el proceso debe realizarse en condiciones estériles (asépticas) para prevenir la contaminación microbiana. Esto añade una complejidad y un costo significativos al diseño y operación de las instalaciones.
Desarrollo de la formulación
No todas las formulaciones de fármacos son adecuadas para la liofilización. Se requiere un trabajo de desarrollo significativo para crear una receta con los excipientes adecuados (ingredientes estabilizadores) que puedan proteger el API durante las tensiones de congelación y secado y dar como resultado un producto final estable y elegante.
Aplicando esto a su objetivo
Su enfoque de la liofilización depende completamente de su objetivo específico dentro de la cadena de valor farmacéutica.
- Si su enfoque principal es la estabilidad a largo plazo de un producto biológico: La liofilización es el estándar de la industria y, a menudo, el único camino viable para crear un producto con una vida útil de varios años.
- Si su enfoque principal es simplificar la logística global: La liofilización crea un producto ligero y tolerante a la temperatura que reduce drásticamente los costos y la complejidad de la cadena de frío.
- Si su enfoque principal es el descubrimiento de fármacos en etapa inicial: Utilice la liofilización a escala de laboratorio para preservar la integridad de nuevos compuestos y muestras biológicas, asegurando la consistencia en su investigación.
- Si su enfoque principal es crear diagnósticos fáciles de usar: La incorporación de reactivos liofilizados es clave para producir kits estables y portátiles que brinden resultados precisos en el campo.
En última instancia, la liofilización es una tecnología fundamental que hace posibles muchas de las terapias más avanzadas de la medicina moderna.
Tabla resumen:
| Beneficio clave | Impacto en los productos farmacéuticos |
|---|---|
| Estabilidad mejorada | Previene la degradación de proteínas, vacunas y productos biológicos, manteniendo la eficacia. |
| Vida útil prolongada | Transforma líquidos perecederos en sólidos estables que duran años, no días. |
| Logística simplificada | Reduce la dependencia de las cadenas de frío, permitiendo la distribución global a áreas remotas. |
| Reconstitución rápida | La estructura de pastel poroso permite una disolución rápida para la administración al paciente. |
¿Listo para mejorar su desarrollo farmacéutico con soluciones confiables de liofilización? KINTEK se especializa en equipos de laboratorio de precisión, incluidos liofilizadores adaptados para I+D, ensayos clínicos y fabricación comercial. Ya sea que esté estabilizando productos biológicos sensibles, desarrollando vacunas o creando diagnósticos portátiles, nuestra experiencia garantiza que sus productos mantengan su integridad desde el laboratorio hasta el paciente. Contáctenos hoy para analizar cómo nuestras soluciones pueden respaldar sus objetivos de estabilidad y logística.
Guía Visual
Productos relacionados
- Esterilizador de Laboratorio Autoclave Máquina Esterilizadora de Polvo de Hierbas para Plantas
- Esterilizador de autoclave de laboratorio rápido de escritorio de 35L 50L 90L para uso en laboratorio
- Tamices de Laboratorio y Máquina Vibratoria Tamizadora
- Molino Criogénico de Nitrógeno Líquido, Pulverizador Ultrafino de Flujo de Aire Cryomill
- Prensa Hidráulica Manual Calentada con Placas Calentadas para Prensa en Caliente de Laboratorio
La gente también pregunta
- ¿Cuál es la necesidad de usar un autoclave de vapor para aleaciones dentales? Garantizar datos puros de adhesión bacteriana
- ¿Cómo deben prepararse los materiales sólidos en bolsas para la descontaminación en diferentes tipos de autoclaves para garantizar una penetración adecuada del vapor?
- ¿Cuál es el propósito principal de un autoclave en la preparación de medios para la lixiviación biológica de uranio?
- ¿Por qué es fundamental la prevención del atrapamiento de aire en el proceso de esterilización en autoclave? Garantice el 100 % de esterilidad hoy mismo.
- ¿Qué condiciones experimentales proporcionan las autoclaves de acero inoxidable para la lixiviación PCT-A? Optimización de pruebas de vidrio de fosfato