Sí, el diamante es un conductor térmico muy superior al grafito. Aunque ambos son formas puras de carbono, la estructura atómica única del diamante le permite transferir calor con una eficiencia extrema, lo que lo convierte en uno de los mejores conductores térmicos de cualquier material conocido a temperatura ambiente. Su conductividad térmica puede ser más de cinco veces superior a la del cobre y muchas veces superior a la del grafito.
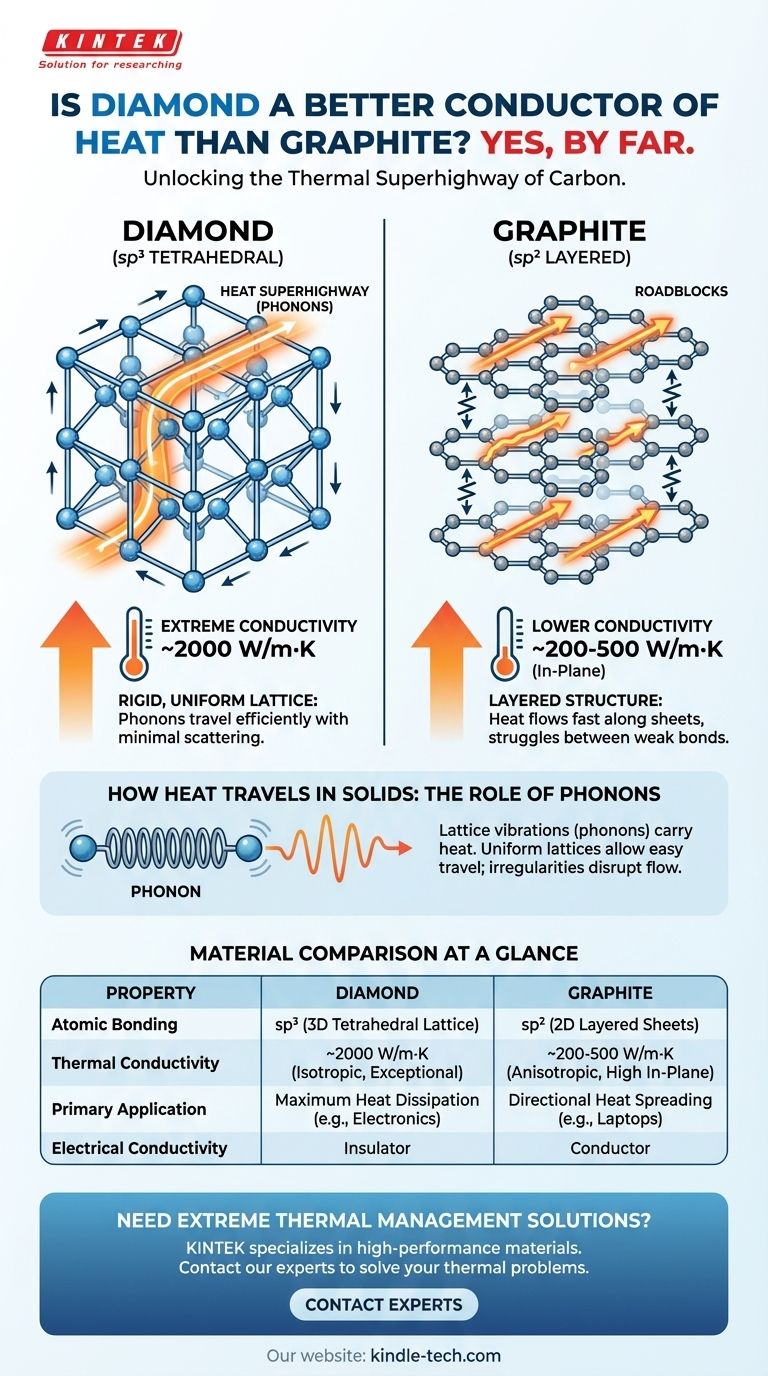
La razón principal de esta diferencia no reside en su composición química, sino en su arquitectura atómica. La red rígida y tridimensional del diamante es una "superautopista" altamente eficiente para la energía térmica, mientras que la estructura en capas del grafito crea importantes obstáculos que impiden el flujo térmico.
Cómo Viaja el Calor en los Sólidos: El Papel de los Fonones
¿Qué es un Fonón?
En un sólido eléctricamente aislante, el calor no es transportado por electrones, sino por vibraciones de la red. Piense en los átomos del cristal como si estuvieran conectados por muelles. Una vibración en un extremo crea una onda que viaja a través de toda la estructura.
Estas ondas cuantificadas de vibración atómica se llaman fonones. La eficiencia de la conducción del calor depende de la facilidad con la que estos fonones pueden viajar a través del material sin ser dispersados o interrumpidos.
La Importancia de una Red Rígida y Uniforme
Un material perfecto para la conducción del calor tiene enlaces atómicos fuertes y rígidos y una estructura altamente ordenada y uniforme. Esto permite que la energía vibracional (fonones) se propague limpiamente con una resistencia mínima.
Cualquier irregularidad, impureza o debilidad en la red actúa como un punto de dispersión, interrumpiendo el flujo de fonones y reduciendo la conductividad térmica.
La Ventaja del Diamante: Una Red Perfecta para la Transferencia de Calor
La Estructura Tetraédrica con Enlaces sp³
Cada átomo de carbono en un diamante está unido a otros cuatro átomos de carbono en una disposición tetraédrica. Este enlace sp³ se repite en las tres dimensiones, creando una red cúbica increíblemente fuerte, rígida y continua.
Esta estructura es lo que hace del diamante el material natural más duro conocido. No hay puntos débiles o planos dentro del cristal.
Por Qué Esta Estructura Destaca en el Transporte de Fonones
La red rígida y perfectamente uniforme del diamante es un medio ideal para el transporte de fonones. Los fuertes enlaces covalentes permiten que la energía vibracional viaje a velocidades muy altas con muy poca dispersión.
Esto convierte al diamante en un conductor térmico excepcional, con una conductividad de alrededor de 2000 W/m·K. Por esta razón, el diamante se utiliza como disipador de calor para componentes electrónicos de alta potencia donde la disipación de calor es crítica.
La Limitación del Grafito: Una Historia de Dos Direcciones
La Estructura en Capas con Enlaces sp²
En el grafito, cada átomo de carbono está unido a solo otros tres en una lámina plana y hexagonal. Este enlace sp² es muy fuerte, pero solo dentro del plano bidimensional de la lámina.
Estas láminas se apilan una encima de la otra y se mantienen unidas por fuerzas mucho más débiles (fuerzas de van der Waals). Esta estructura en capas es lo que permite que el grafito sea quebradizo y actúe como un buen lubricante, ya que las capas pueden deslizarse fácilmente una sobre otra.
Conductividad Anisotrópica: Rápida a lo Largo de las Láminas, Lenta Entre Ellas
Esta estructura en capas hace que la conductividad térmica del grafito sea anisotrópica, lo que significa que es diferente en distintas direcciones.
El calor viaja de manera muy eficiente a lo largo de las láminas hexagonales, pero le cuesta saltar de una lámina a la siguiente a través de los enlaces débiles. La débil conexión interlaminar actúa como un importante cuello de botella para el transporte de fonones.
Como resultado, la conductividad térmica general del grafito es significativamente menor que la del diamante, oscilando típicamente entre 200 y 500 W/m·K dentro de los planos y mucho menos entre ellos.
Comprendiendo las Ventajas y Desventajas: Estabilidad vs. Rendimiento
La Paradoja de la Estabilidad Termodinámica
Las referencias señalan correctamente que a temperatura y presión estándar, el grafito es la forma termodinámicamente más estable del carbono. El diamante es técnicamente metaestable.
Sin embargo, esta estabilidad termodinámica no influye en su rendimiento térmico. Las propiedades de un material están dictadas por su estructura, no por su estabilidad relativa.
La Barrera de Energía de Activación
El diamante no se convierte espontáneamente en el grafito más estable porque una barrera de energía de activación muy grande separa las dos formas.
Se requiere una inmensa cantidad de energía para romper los rígidos enlaces sp³ del diamante y permitir que se reformen en la estructura sp² del grafito. Esta alta barrera es lo que hace que los diamantes sean efectivamente permanentes en condiciones normales.
Tomando la Decisión Correcta para su Objetivo
Al seleccionar un alótropo de carbono, la aplicación dicta la elección.
- Si su objetivo principal es la máxima disipación térmica: El diamante es la elección inigualable, utilizado para disipadores de calor de alto rendimiento, herramientas de corte y sustratos electrónicos especializados.
- Si su objetivo principal es la propagación de calor direccional y rentable: Las láminas de grafito son excelentes para mover el calor lateralmente desde una fuente, una estrategia común en la electrónica de consumo como teléfonos y ordenadores portátiles.
- Si su objetivo principal es la conductividad eléctrica o la lubricación: El grafito es la opción superior, ya que sus electrones deslocalizados le permiten conducir la electricidad y sus débiles enlaces interlaminados le permiten actuar como lubricante seco.
En última instancia, comprender el vínculo directo entre la estructura atómica de un material y sus propiedades físicas es clave para resolver cualquier desafío de ingeniería.

Tabla Resumen:
| Propiedad | Diamante | Grafito |
|---|---|---|
| Enlace Atómico | sp³ (red tetraédrica 3D) | sp² (láminas en capas 2D) |
| Conductividad Térmica | ~2000 W/m·K (excepcional, isotrópica) | 200-500 W/m·K (anisotrópica, alta en el plano) |
| Aplicación Principal | Máxima disipación de calor (ej., electrónica) | Dispersión de calor direccional (ej., ordenadores portátiles) |
| Conductividad Eléctrica | Aislante | Conductor |
¿Necesita una solución material para la gestión térmica extrema?
KINTEK se especializa en equipos y materiales de laboratorio de alto rendimiento, incluyendo soluciones térmicas avanzadas. Ya sea que su proyecto requiera la disipación de calor inigualable del diamante o las propiedades direccionales y rentables del grafito, nuestra experiencia puede ayudarle a seleccionar el material perfecto para su aplicación específica.
Contacte a nuestros expertos hoy mismo para discutir cómo podemos mejorar las capacidades de su laboratorio y resolver sus problemas térmicos más desafiantes.
Guía Visual
Productos relacionados
- Diamante CVD para Aplicaciones de Gestión Térmica
- Cúpulas de Diamante CVD para Aplicaciones Industriales y Científicas
- Disipador de calor corrugado plano de cerámica de carburo de silicio (SiC) para cerámica fina avanzada de ingeniería
- Blankos de Herramientas de Corte de Diamante CVD para Mecanizado de Precisión
- Sistema de Reactor de Máquina MPCVD de Resonador Cilíndrico para Deposición Química de Vapor de Plasma de Microondas y Crecimiento de Diamantes de Laboratorio
La gente también pregunta
- ¿Qué es el material sinterizado? Una guía de la metalurgia de polvos de alto rendimiento
- ¿Cuál es la fuente del bioaceite? Desbloqueando la energía renovable a partir de la biomasa
- ¿Cuáles son los desafíos de la biorrefinería? Superando los obstáculos clave para la producción sostenible de combustible
- ¿Cómo funciona el proceso de centrifugación? Desbloquee la separación rápida para su laboratorio
- ¿Se pueden convertir los residuos plásticos en combustible? Descubra los métodos, beneficios y riesgos.
- ¿Qué se entiende por vidrio sinterizado? Una guía de su estructura porosa y usos
- ¿Cuáles son los peligros asociados con el aire comprimido? Comprenda los peligros ocultos en sus instalaciones
- ¿Cuál es la temperatura del tratamiento térmico? Depende de su metal y de las propiedades deseadas



















