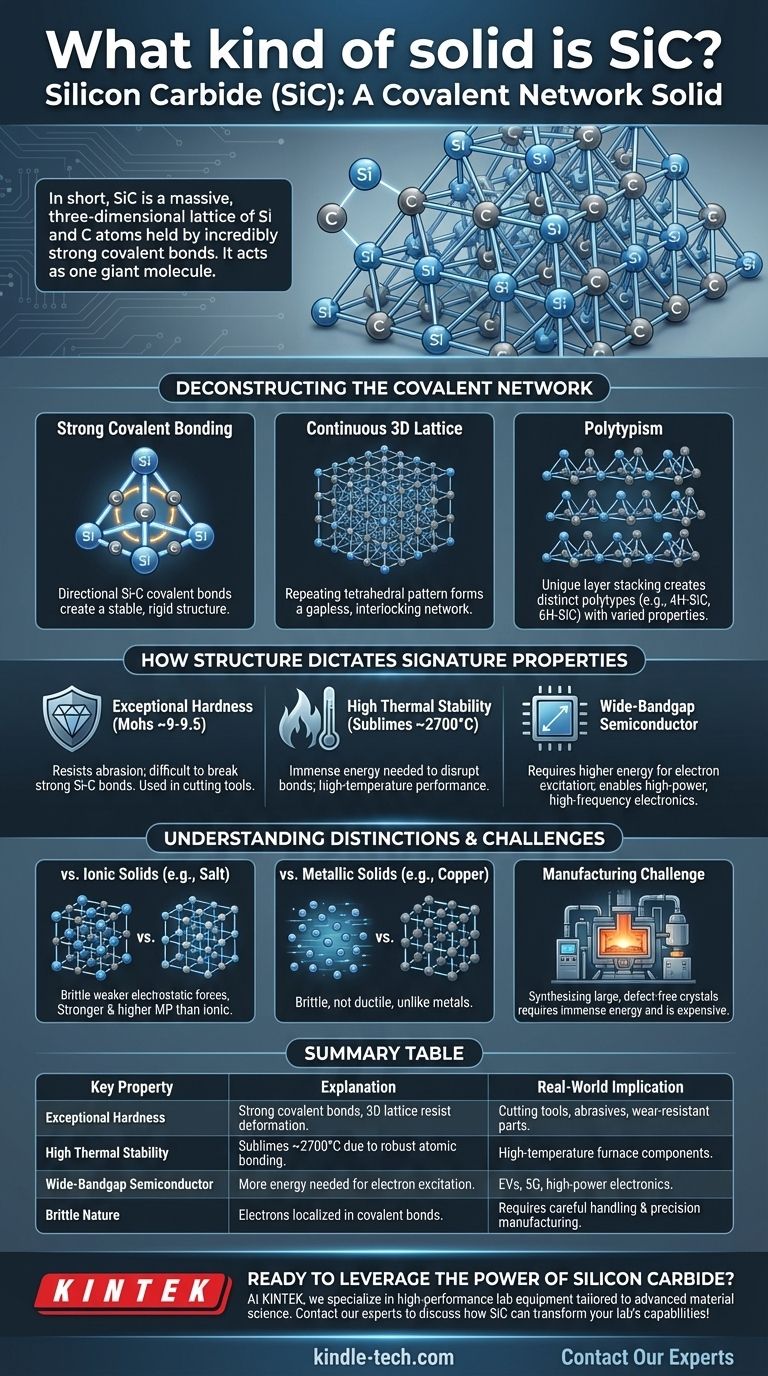
En resumen, el Carburo de Silicio (SiC) es un sólido de red covalente. Esta clasificación significa que sus átomos de silicio y carbono están unidos en una red tridimensional masiva, mantenida unida por enlaces covalentes extremadamente fuertes y direccionales. A diferencia de los sólidos moleculares con fuerzas débiles entre moléculas, todo el cristal de SiC actúa eficazmente como una única molécula gigante.
La clasificación del SiC como un sólido de red covalente no es solo una etiqueta; es la explicación fundamental de sus propiedades excepcionales. Comprender su rígida red atómica es la clave para entender su dureza extrema, su estabilidad a altas temperaturas y su comportamiento electrónico único.

Deconstruyendo la Estructura de Red Covalente
Para entender el SiC, primero debe visualizar su arquitectura atómica subyacente. Es esta estructura la que dicta casi todas sus características útiles.
La Naturaleza del Enlace Covalente en el SiC
El Carburo de Silicio está formado por átomos de silicio (Si) y carbono (C). Estos dos elementos tienen una diferencia relativamente pequeña en electronegatividad, lo que hace que compartan electrones y formen enlaces covalentes muy fuertes y estables.
Estos enlaces son altamente direccionales. Cada átomo de carbono está unido a cuatro átomos de silicio, y cada átomo de silicio está unido a cuatro átomos de carbono en una disposición tetraédrica rígida.
Una Red 3D Continua
Este patrón de enlace tetraédrico se repite infinitamente en las tres dimensiones. Esto crea una red continua e interconectada sin puntos débiles ni moléculas individuales.
Piense en ello como una estructura similar al diamante, pero con átomos de silicio y carbono alternados en lugar de solo carbono. Esta estructura rígida y sin huecos es la fuente de la inmensa fuerza física del SiC.
El Concepto de Politipismo
Una característica única del SiC es el politipismo. Si bien el enlace tetraédrico Si-C local es constante, las capas de estos tetraedros pueden apilarse en diferentes secuencias.
Estas diferentes disposiciones de apilamiento crean distintas estructuras cristalinas llamadas politipos, como el 4H-SiC y el 6H-SiC. Aunque todos son SiC, estos politipos tienen propiedades electrónicas ligeramente diferentes, lo que los hace adecuados para diferentes aplicaciones de semiconductores.
Cómo la Estructura Dicta las Propiedades Distintivas del SiC
El modelo de red covalente explica directamente por qué el SiC se comporta de la manera en que lo hace. Las propiedades macroscópicas del material son una consecuencia directa de su unión y estructura microscópicas.
Dureza y Resistencia Excepcionales
Para rayar o deformar el SiC, debe romper físicamente los potentes enlaces covalentes Si-C. Debido a que todo el cristal es una única red de estos enlaces, exhibe una increíble resistencia a la abrasión y la deformación.
En la escala de Mohs de dureza, el SiC (~9-9.5) es superado solo por el diamante (10), lo que lo convierte en un material de élite para herramientas de corte, abrasivos y componentes resistentes al desgaste.
Alta Estabilidad Térmica
Fundir o descomponer un sólido requiere dar a sus átomos suficiente energía para superar las fuerzas que los mantienen unidos. La inmensa fuerza de los enlaces covalentes Si-C significa que se necesita una gran cantidad de energía térmica para romper la red.
En consecuencia, el SiC no se funde a presión atmosférica, sino que sublima (se convierte directamente en gas) a temperaturas extremadamente altas, alrededor de 2700 °C (4900 °F).
Comportamiento Semiconductor Único
Si bien los enlaces fuertes son característicos de un aislante eléctrico como el diamante, la energía requerida para excitar un electrón a un estado conductor (la banda prohibida) en el SiC es menor que en el diamante.
Esto coloca al SiC en una categoría especial de semiconductores de banda prohibida ancha. Su banda prohibida es significativamente más ancha que la del silicio puro, lo que permite que la electrónica basada en SiC opere a voltajes, temperaturas y frecuencias mucho más altas.
Comprendiendo las Ventajas y Distinciones
Situar el SiC en el contexto de otros sólidos aclara su posición única. Sus propiedades son una compensación definida por su enlace.
SiC vs. Sólidos Iónicos (ej., Sal)
Los sólidos iónicos como el cloruro de sodio (NaCl) se mantienen unidos por la atracción electrostática no direccional entre iones positivos y negativos. Aunque forman cristales, estos enlaces son generalmente más débiles que los enlaces covalentes del SiC, lo que los hace más blandos y les confiere puntos de fusión mucho más bajos.
SiC vs. Sólidos Metálicos (ej., Cobre)
Los metales se caracterizan por un "mar" de electrones deslocalizados que rodean una red de iones positivos. Este mar de electrones permite que los metales sean conductores y dúctiles (maleables). En contraste, los electrones del SiC están confinados en enlaces covalentes localizados, lo que lo convierte en un semiconductor e inherentemente frágil.
El Desafío de la Fabricación
La misma fuerza que hace que el SiC sea tan deseable también lo hace increíblemente difícil de producir. La síntesis de monocristales grandes y sin defectos de SiC requiere una inmensa energía y procesos sofisticados (como el método Lely), lo que lo hace significativamente más caro que el silicio.
Tomando la Decisión Correcta para Su Aplicación
Comprender la clasificación del SiC como un sólido de red covalente le permite predecir su comportamiento y sus mejores casos de uso.
- Si su enfoque principal es el rendimiento mecánico: Reconozca que su red covalente es la fuente directa de su dureza de primer nivel y resistencia al desgaste, lo que lo hace ideal para abrasivos, chorro de arena y sellos mecánicos duraderos.
- Si su enfoque principal es la electrónica de alta potencia: Comprenda que su red covalente crea un semiconductor de banda prohibida ancha, esencial para construir inversores de potencia robustos, cargadores de vehículos eléctricos y módulos de comunicación 5G que superan al silicio.
- Si su enfoque principal es la ciencia de materiales: Clasifique el SiC como un sólido de red covalente prototípico, utilizándolo como punto de referencia para la dureza y la estabilidad térmica al compararlo con otras cerámicas avanzadas como el nitruro de boro o el nitruro de silicio.
En última instancia, saber que el Carburo de Silicio es un sólido de red covalente es el primer principio para comprender y aplicar sus extraordinarias capacidades.
Tabla Resumen:
| Propiedad Clave | Explicación | Implicación en el Mundo Real |
|---|---|---|
| Dureza Excepcional | Fuertes enlaces covalentes en una red 3D resisten la deformación. | Ideal para herramientas de corte, abrasivos y piezas resistentes al desgaste. |
| Alta Estabilidad Térmica | Sublima a ~2700°C debido a la robusta unión atómica. | Adecuado para aplicaciones de alta temperatura como componentes de hornos. |
| Semiconductor de Banda Prohibida Ancha | Los electrones requieren más energía para excitarse, lo que permite una operación de alta potencia. | Utilizado en vehículos eléctricos, tecnología 5G y electrónica de potencia para un rendimiento superior. |
| Naturaleza Frágil | Los electrones están localizados en enlaces covalentes, lo que limita la ductilidad. | Requiere manipulación cuidadosa y procesos de fabricación de precisión. |
¿Listo para aprovechar el poder del Carburo de Silicio en su laboratorio? En KINTEK, nos especializamos en proporcionar equipos de laboratorio y consumibles de alto rendimiento adaptados a las necesidades avanzadas de la ciencia de materiales. Ya sea que esté desarrollando semiconductores de próxima generación o requiera componentes duraderos para procesos de alta temperatura, nuestra experiencia garantiza que obtenga las soluciones adecuadas para resultados superiores. ¡Contacte a nuestros expertos hoy mismo para discutir cómo el SiC puede transformar las capacidades de su laboratorio!
Guía Visual
Productos relacionados
- Lámina Cerámica de Carburo de Silicio (SiC) Resistente al Desgaste, Cerámica Avanzada Fina de Ingeniería
- Elementos Calefactores de Carburo de Silicio SiC para Horno Eléctrico
- Soportes personalizados de PTFE para obleas para laboratorios y procesamiento de semiconductores
- Lente de silicio monocristalino de alta resistencia infrarroja
- Nitruro de Boro (BN) Cerámica Avanzada de Ingeniería Cerámica
La gente también pregunta
- ¿Cuál es la temperatura de sinterización de las piezas cerámicas? Una guía para los ciclos de sinterización específicos de cada material
- ¿Cuál es la temperatura máxima para las cerámicas? Encuentre el material adecuado para su aplicación de alta temperatura
- ¿Se rompe la cerámica con los cambios de temperatura? La importancia crítica del choque térmico explicada
- ¿A qué temperatura sinteriza la arcilla? Dominando el rango para resultados cerámicos perfectos
- ¿Cuánto dura la cerámica? Maximice la vida útil y la protección de su recubrimiento
- ¿Es la cerámica un buen material? Una guía de sus fortalezas extremas y sus desventajas
- ¿Qué son los materiales cerámicos? Comprendiendo sus propiedades fundamentales y aplicaciones industriales
- ¿Es fácil mecanizar el carburo de silicio? Superando el obstáculo de la dureza para sus componentes



















