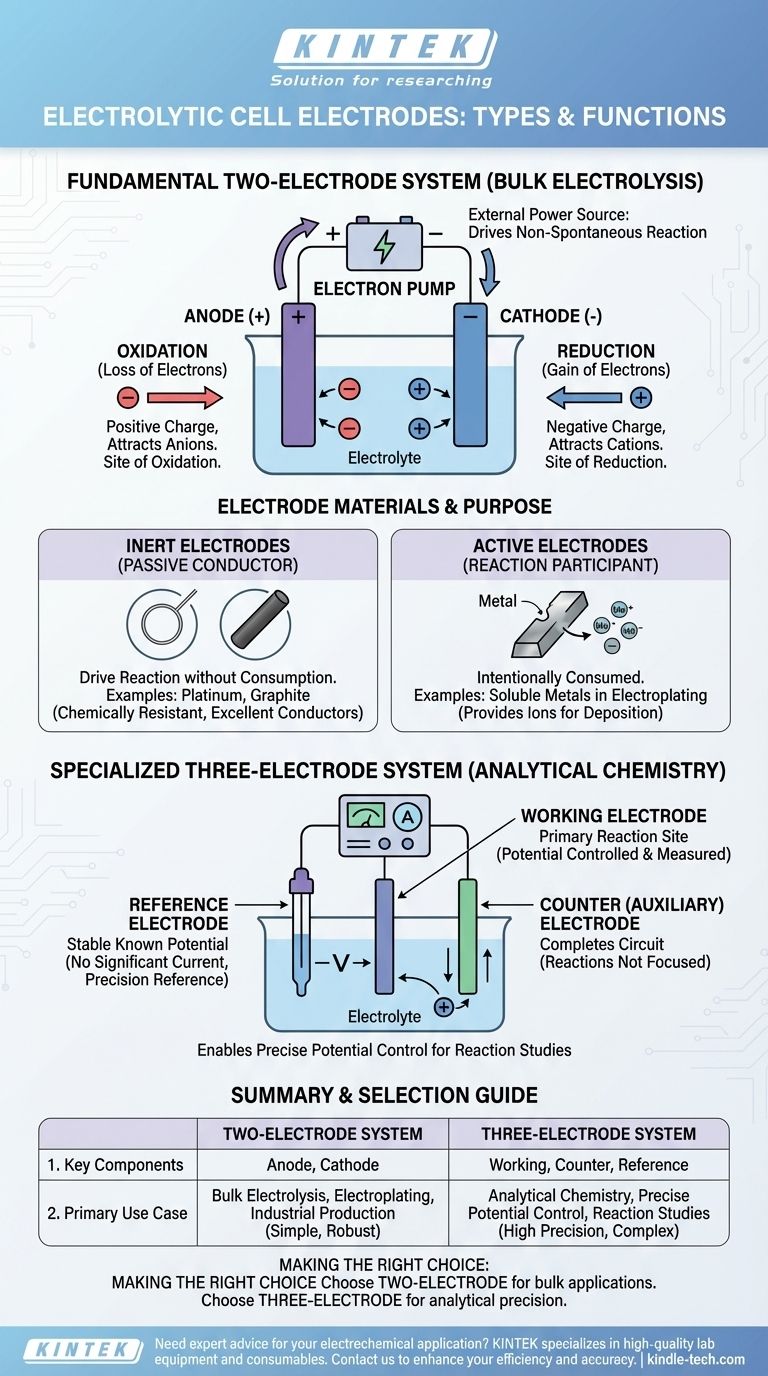
En esencia, una celda electrolítica utiliza dos electrodos principales: un ánodo cargado positivamente donde ocurre la oxidación y un cátodo cargado negativamente donde ocurre la reducción. Para un trabajo analítico más preciso, se utiliza un sistema de tres electrodos, que consta de un electrodo de trabajo, un electrodo auxiliar y un electrodo de referencia.
El tipo y el número de electrodos utilizados en una celda electrolítica están determinados por su propósito. Una configuración simple de dos electrodos (ánodo y cátodo) es suficiente para impulsar una reacción química, mientras que un sistema de tres electrodos es necesario para medirla y controlarla con precisión.

El Sistema Fundamental de Dos Electrodos
La mayoría de las celdas electrolíticas, desde demostraciones en el aula hasta la producción a escala industrial, se basan en una estructura de dos electrodos. Este sistema utiliza una fuente de alimentación externa para forzar la ocurrencia de una reacción química no espontánea.
El Ánodo: Sitio de Oxidación
El ánodo es el electrodo conectado al terminal positivo de la fuente de alimentación. Debido a su carga positiva, atrae iones cargados negativamente (aniones) de la solución electrolítica. En la superficie del ánodo, estos iones pierden electrones en un proceso llamado oxidación.
El Cátodo: Sitio de Reducción
A la inversa, el cátodo está conectado al terminal negativo de la fuente de alimentación. Su carga negativa atrae iones cargados positivamente (cationes). En la superficie del cátodo, estos iones ganan electrones en un proceso conocido como reducción.
El Papel de la Fuente de Alimentación Externa
A diferencia de una batería (una celda galvánica) que genera voltaje, una celda electrolítica lo consume. La fuente de alimentación actúa como una "bomba de electrones", extrayendo electrones del ánodo y empujándolos hacia el cátodo, imponiendo así la carga e impulsando todo el proceso.
Materiales de los Electrodos y su Propósito
El material del que está hecho un electrodo es fundamental para la función de la celda. La elección depende de si el electrodo debe ser un participante activo o un observador pasivo en la reacción.
Electrodos Inertes: El Conductor Pasivo
En muchas aplicaciones, el objetivo es impulsar una reacción dentro del electrolito sin que el electrodo en sí se consuma. En estos casos, se utilizan electrodos inertes. Materiales como el platino y el grafito (una forma de carbono) son opciones comunes porque son excelentes conductores eléctricos pero son químicamente resistentes y es poco probable que reaccionen.
Electrodos Activos: El Participante de la Reacción
En algunos procesos, como la galvanoplastia o el refinado, el ánodo está diseñado intencionalmente para consumirse. Un electrodo activo está hecho de un material que se oxida y se disuelve en el electrolito, proporcionando los iones metálicos que luego se depositarán en el cátodo.
El Sistema Especializado de Tres Electrodos
Para la química analítica, donde el objetivo es estudiar una reacción en lugar de realizar electrólisis en masa, se requiere un sistema de tres electrodos más sofisticado. Esta configuración permite un control extremadamente preciso del potencial del electrodo.
El Electrodo de Trabajo
Este es el electrodo principal donde ocurre la reacción de interés. Su potencial eléctrico es la variable que se controla y mide cuidadosamente.
El Electrodo Auxiliar (o Contraelectródo)
El único propósito del electrodo auxiliar es completar el circuito eléctrico. La corriente fluye entre el electrodo de trabajo y el electrodo auxiliar, pero las reacciones que ocurren en el electrodo auxiliar no son el foco del experimento.
El Electrodo de Referencia
Esta es la clave de la precisión del sistema. Un electrodo de referencia proporciona un potencial eléctrico estable y conocido. No fluye corriente significativa a través de él, por lo que su potencial permanece constante. Al medir el potencial del electrodo de trabajo en comparación con esta referencia estable, un investigador puede conocer y controlar su voltaje con gran precisión.
Comprender las Compensaciones
Elegir un sistema implica equilibrar la simplicidad con la necesidad de control.
El Sistema de Dos Electrodos: Simplicidad para la Producción
Esta configuración es simple, robusta e ideal para aplicaciones a gran escala como la producción de gas cloro o aluminio. Su limitación es la falta de control preciso del potencial, ya que el voltaje aplicado se divide de manera impredecible entre los dos electrodos y el electrolito.
El Sistema de Tres Electrodos: Precisión para el Análisis
Este sistema ofrece un control exquisito, lo cual es esencial para estudiar mecanismos de reacción y realizar análisis electroquímicos sensibles. Sin embargo, es más complejo y generalmente se utiliza para trabajos de laboratorio de baja corriente, no para la producción industrial.
Tomar la Decisión Correcta para su Objetivo
Su objetivo dicta la configuración de electrodos necesaria.
- Si su enfoque principal es la electrólisis en masa o una demostración simple (por ejemplo, división de agua, galvanoplastia): Un sistema de dos electrodos (ánodo y cátodo) hecho de materiales apropiados es la opción correcta y más eficiente.
- Si su enfoque principal es la medición analítica o el estudio de un mecanismo de reacción: Un sistema de tres electrodos (trabajo, auxiliar, referencia) es esencial para la precisión y el control requeridos.
En última instancia, comprender la función de cada electrodo le permite seleccionar las herramientas adecuadas para la tarea química en cuestión.
Tabla Resumen:
| Sistema de Electrodos | Componentes Clave | Caso de Uso Principal |
|---|---|---|
| Dos Electrodos | Ánodo (Oxidación), Cátodo (Reducción) | Electrólisis en Masa, Galvanoplastia, Producción Industrial |
| Tres Electrodos | Electrodos de Trabajo, Auxiliar y de Referencia | Química Analítica, Control Preciso del Potencial, Estudios de Reacciones |
¿Necesita asesoramiento experto sobre la selección de los electrodos adecuados para su aplicación electroquímica? KINTEK se especializa en equipos de laboratorio y consumibles de alta calidad para todas sus necesidades de laboratorio. Ya sea que se esté preparando para la producción industrial o para un trabajo analítico preciso, nuestro equipo puede ayudarle a elegir el sistema óptimo para mejorar su eficiencia y precisión. ¡Contáctenos hoy para discutir sus requisitos específicos!
Guía Visual
Productos relacionados
- Electrodo de Referencia de Sulfato de Cobre para Uso en Laboratorio
- Electrodo de Lámina de Platino para Aplicaciones de Laboratorio e Industriales
- Electrodo de lámina de platino para aplicaciones de laboratorio de baterías
- Bañera de agua para celda electrolítica electroquímica multifuncional de una o dos capas
- Colector de corriente de papel de aluminio para batería de litio
La gente también pregunta
- ¿Cuál es el principio de funcionamiento de un electrodo de referencia de sulfato de cobre? Explicación de la medición de potencial fiable
- ¿Cómo se debe mantener un electrodo de referencia de sulfato de cobre? Asegure mediciones electroquímicas precisas
- ¿Cuáles son los procedimientos post-tratamiento después de usar un electrodo de referencia de sulfato de cobre? Pasos esenciales para la precisión y la longevidad
- ¿Cuáles son los pasos de pretratamiento antes de usar un electrodo de referencia portátil de sulfato de cobre? Asegure mediciones precisas del potencial de corrosión
- ¿Cuál es la vida útil esperada de un electrodo de referencia de sulfato de cobre? Maximice la longevidad con un mantenimiento adecuado