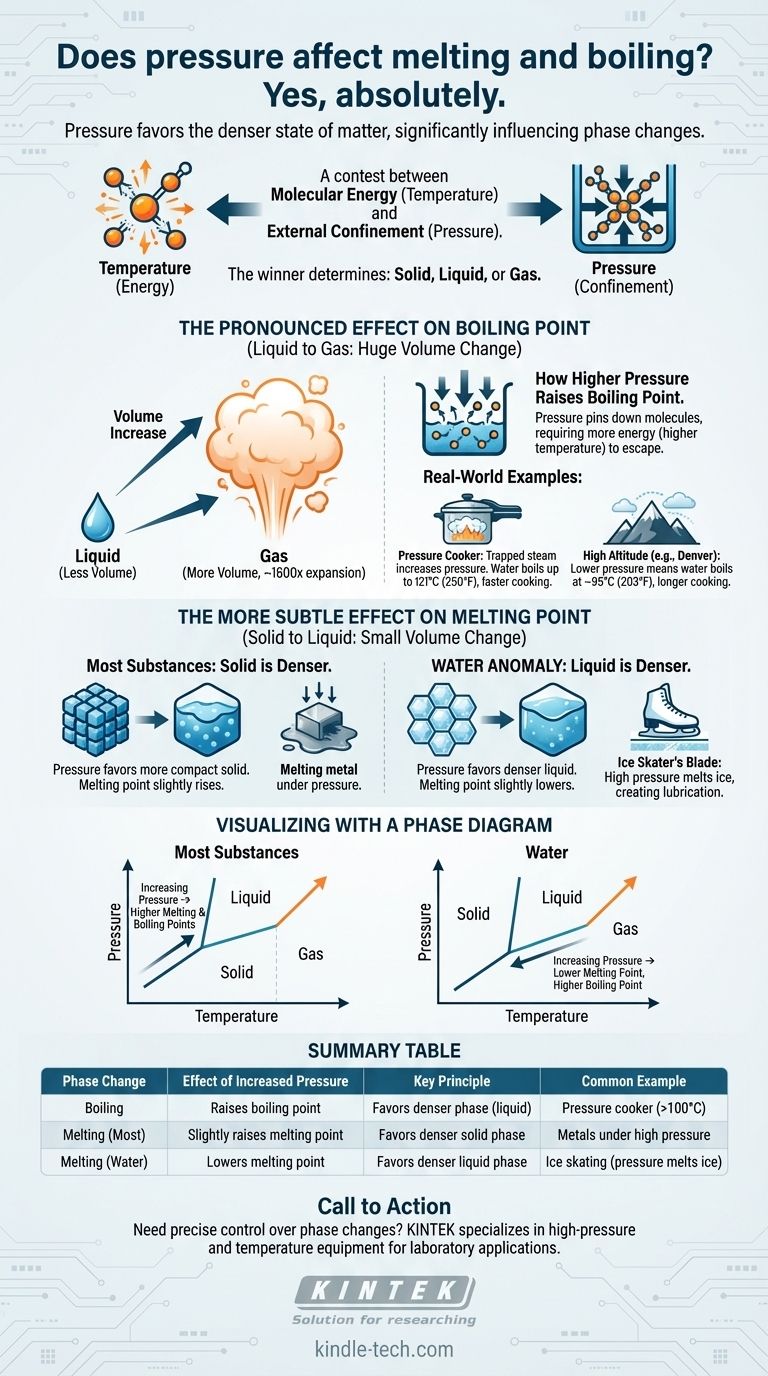
Sí, absolutamente. La presión es un factor crítico que influye directamente en las temperaturas a las que las sustancias cambian de fase. El aumento de la presión externa generalmente eleva significativamente el punto de ebullición de un líquido. Su efecto sobre el punto de fusión es más sutil pero sigue un principio claro: la presión favorece el estado de la materia más denso.
El principio central es una contienda entre la energía molecular (temperatura) y el confinamiento externo (presión). La temperatura da a las moléculas la energía para liberarse en un estado menos ordenado, mientras que la presión las fuerza a unirse en un estado más compacto y denso. El ganador de esta contienda determina si una sustancia es sólida, líquida o gaseosa.

Por qué la presión influye en los cambios de fase
La batalla entre energía y confinamiento
Un cambio de fase, como la fusión o la ebullición, ocurre cuando las moléculas ganan suficiente energía térmica para superar las fuerzas que las mantienen en una estructura fija. La temperatura proporciona esta energía.
La presión, por otro lado, es una fuerza externa que empuja las moléculas. Actúa como una forma de confinamiento, lo que dificulta que las moléculas se dispersen y hagan la transición a una fase menos densa.
Cuestión de volumen y densidad
La clave para comprender el efecto de la presión reside en el volumen. Cuando una sustancia se funde o hierve, su volumen y densidad cambian.
La presión siempre favorecerá la fase que ocupe menos volumen, la fase más densa. Esta única regla explica por qué la presión afecta la ebullición y la fusión de manera diferente.
El efecto pronunciado sobre el punto de ebullición
De líquido a gas: un enorme cambio de volumen
La transición de un líquido a un gas implica un aumento masivo de volumen. Una sola gota de agua, por ejemplo, se expande para ocupar un espacio más de 1.600 veces mayor cuando se convierte en vapor.
Debido a que este cambio de volumen es tan grande, la presión tiene un impacto muy fuerte y directo en el punto de ebullición.
Cómo una mayor presión eleva el punto de ebullición
Cuando se aumenta la presión sobre la superficie de un líquido, esencialmente se están "sujetando" las moléculas. Ahora requieren mucha más energía cinética (una temperatura más alta) para escapar a la fase gaseosa.
Por esta razón, el punto de ebullición de casi todas las sustancias aumenta a medida que aumenta la presión.
Ejemplo del mundo real: la olla a presión
Una olla a presión funciona sellando una olla, atrapando el vapor producido por el agua hirviendo. Este vapor atrapado aumenta drásticamente la presión en el interior.
Bajo esta alta presión, el punto de ebullición del agua puede subir de 100 °C (212 °F) a 121 °C (250 °F). Esta agua más caliente transfiere calor más rápidamente, reduciendo drásticamente los tiempos de cocción.
Ejemplo del mundo real: cocinar a gran altitud
Lo contrario ocurre a grandes altitudes. En Denver, Colorado (a 5.280 pies), la presión atmosférica es menor.
Con menos presión atmosférica que retenga las moléculas de agua, estas pueden escapar a la fase gaseosa más fácilmente. El agua allí hierve a unos 95 °C (203 °F), lo que significa que los alimentos deben cocinarse durante más tiempo.
El efecto más sutil sobre el punto de fusión
De sólido a líquido: un pequeño cambio de volumen
A diferencia de la ebullición, el cambio de volumen durante la fusión es muy pequeño. Las densidades de una sustancia en sus formas sólida y líquida suelen ser bastante similares.
Debido a que el cambio de volumen es mínimo, la presión tiene un efecto mucho menos drástico sobre el punto de fusión.
Para la mayoría de las sustancias: una mayor presión eleva el punto de fusión
La mayoría de los materiales, desde metales hasta ceras y dióxido de carbono, son más densos en su forma sólida que en su forma líquida.
En estos casos, el aumento de la presión favorece la fase sólida más compacta. Esto hace que sea un poco más difícil de fundir, por lo que se requiere una temperatura más alta. El punto de fusión aumenta con la presión.
La anomalía del agua: una excepción crucial
El agua es una excepción notable y rara. El agua sólida (hielo) es menos densa que el agua líquida, por lo que el hielo flota.
Debido a que el agua líquida es la fase más densa, el aumento de la presión sobre el hielo favorece la formación de líquido. Esto significa que bajo alta presión, el hielo se derretirá a una temperatura inferior a 0 °C (32 °F).
Ejemplo del mundo real: la cuchilla del patinador sobre hielo
La ilustración clásica de este principio es un patinador sobre hielo. La delgada cuchilla del patín concentra todo el peso del patinador en un área diminuta, creando una inmensa presión sobre el hielo.
Esta alta presión hace que el hielo directamente debajo de la cuchilla se derrita a una temperatura ligeramente más baja, creando una capa microscópica de agua que lubrica el camino de la cuchilla.
Comprendiendo las compensaciones: visualizando con un diagrama de fases
Un diagrama de fases es un mapa simple que muestra el estado de una sustancia (sólido, líquido o gas) en cualquier combinación de temperatura y presión.
El límite líquido-gas
La línea que separa las fases líquida y gaseosa siempre se inclina hacia arriba y hacia la derecha. Esto confirma visualmente que a medida que aumenta la presión (moviéndose hacia arriba en el eje vertical), también debe aumentar la temperatura (moviéndose hacia la derecha en el eje horizontal) para que la sustancia hierva.
El límite sólido-líquido
La línea entre las fases sólida y líquida es casi vertical, lo que demuestra que la presión tiene una influencia mucho menor en la fusión.
Para la mayoría de las sustancias, esta línea se inclina ligeramente hacia la derecha (mayor presión, mayor punto de fusión). Para el agua, esta línea se inclina de forma única hacia la izquierda, lo que demuestra que una mayor presión conduce a un punto de fusión más bajo.
Principios clave para la aplicación práctica
Para aplicar este conocimiento de manera efectiva, concéntrese en la sustancia y el tipo de cambio de fase involucrado.
- Si está tratando con ebullición o condensación: Recuerde que la presión es el factor dominante. Una presión más alta significa un punto de ebullición más alto, y una presión más baja significa un punto de ebullición más bajo.
- Si está tratando con fusión o congelación (para la mayoría de los materiales): El efecto de la presión es menor. Una presión más alta aumentará ligeramente el punto de fusión al favorecer el estado sólido más denso.
- Si está tratando específicamente con hielo de agua: Recuerde que es la excepción. Una presión más alta reduce el punto de congelación/fusión al favorecer el estado líquido más denso.
Comprender cómo interactúan la presión y la temperatura le brinda un control directo sobre el estado físico de la materia.
Tabla resumen:
| Cambio de fase | Efecto del aumento de presión | Principio clave | Ejemplo común |
|---|---|---|---|
| Ebullición | Eleva el punto de ebullición | Favorece la fase más densa (líquido) | Olla a presión (el agua hierve a >100°C) |
| Fusión (la mayoría de los materiales) | Eleva ligeramente el punto de fusión | Favorece la fase sólida más densa | Metales bajo alta presión |
| Fusión (agua/hielo) | Reduce el punto de fusión | Favorece la fase líquida más densa | Patinaje sobre hielo (la presión derrite el hielo) |
¿Necesita un control preciso sobre los cambios de fase en sus procesos de laboratorio? KINTEK se especializa en equipos de alta presión y temperatura para aplicaciones de laboratorio. Ya sea que esté desarrollando nuevos materiales, realizando síntesis química o estudiando el comportamiento de fases, nuestros reactores y hornos brindan el control exacto de presión y temperatura que necesita. Contacte a nuestros expertos hoy para discutir cómo nuestras soluciones pueden mejorar la eficiencia y precisión de su investigación.
Guía Visual
Productos relacionados
- Reactores personalizables de alta presión para aplicaciones científicas e industriales avanzadas
- Mini Reactor Autoclave de Alta Presión SS para Uso en Laboratorio
- Reactor Autoclave de Laboratorio de Alta Presión para Síntesis Hidrotermal
- Reactor de Presión de Laboratorio Autoclave de Alta Presión de Acero Inoxidable
- Horno de tubo de vacío de alta presión de laboratorio
La gente también pregunta
- ¿Por qué los autoclaves de alta presión son esenciales para preparar agentes de curado de poliamida de base biológica a partir de ácido dímero?
- ¿Qué funciones desempeñan las autoclaves en la síntesis de zeolitas MFI? Domina el crecimiento cristalino hidrotermal
- ¿Por qué son necesarios los recipientes de reacción sellados de laboratorio en la síntesis hidrotermal de zeolitas? Asegurar la pureza y el rendimiento
- ¿Cuál es el papel de los reactores de alta presión en el estudio de la oxidación de aleaciones? Herramientas esenciales para la investigación supercrítica
- ¿Cómo demuestra su valor un reactor de alta presión en el envejecimiento acelerado? Predicción rápida de la durabilidad del catalizador



















