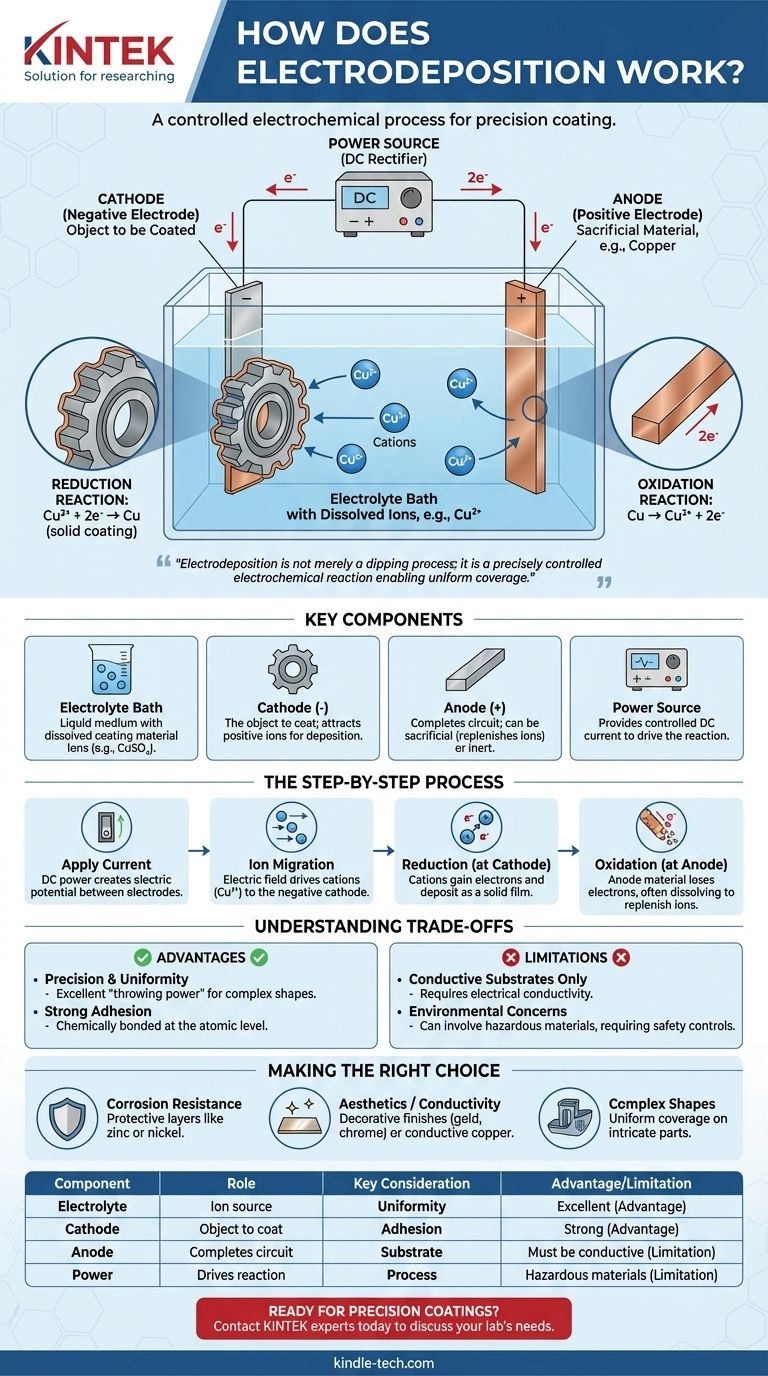
En esencia, la electrodeposición es un proceso que utiliza una corriente eléctrica para recubrir un objeto conductor con una fina capa de material. Esto se logra sumergiendo el objeto (el cátodo) y un segundo electrodo (el ánodo) en una solución química, o baño electrolítico, que contiene iones disueltos del material de recubrimiento. Cuando se aplica una corriente continua, estos iones son atraídos a la superficie del objeto, donde se "depositan" como un sólido, creando una película metálica u orgánica uniforme y adherente.
La clave es que la electrodeposición no es meramente un proceso de inmersión; es una reacción electroquímica controlada con precisión. El campo eléctrico dicta dónde y cómo se forma el recubrimiento, permitiendo la cobertura uniforme incluso de las formas más complejas con una capa cuyo grosor es directamente proporcional a la corriente y el tiempo aplicados.

Los componentes clave de la celda de electrodeposición
Para comprender el proceso, primero debe entender sus componentes fundamentales. Cada configuración de electrodeposición, desde un vaso de laboratorio hasta un tanque industrial, consta de cuatro partes esenciales que trabajan en conjunto.
El baño electrolítico
El electrolito es el medio líquido que facilita todo el proceso. Es una solución, típicamente a base de agua, que contiene sales disueltas del material a depositar. Por ejemplo, en el chapado de cobre, el baño contendría una sal como el sulfato de cobre (CuSO₄), que proporciona los iones de cobre (Cu²⁺).
El cátodo (electrodo negativo)
Este es el objeto que se pretende recubrir. Está conectado al terminal negativo de la fuente de alimentación. La carga negativa en su superficie es lo que atrae los iones metálicos cargados positivamente del baño electrolítico.
El ánodo (electrodo positivo)
Conectado al terminal positivo de la fuente de alimentación, el ánodo completa el circuito eléctrico. Los ánodos pueden ser "sacrificiales", hechos del mismo material que el recubrimiento, disolviéndose para reponer los iones en el baño, o "inertes", hechos de un material no reactivo como el platino o el carbono.
La fuente de energía
Una fuente de alimentación de corriente continua (CC), como un rectificador, proporciona la energía eléctrica necesaria para impulsar la reacción. El voltaje y la corriente se controlan cuidadosamente para gestionar la velocidad y la calidad de la deposición.
El proceso electroquímico paso a paso
Con los componentes en su lugar, el proceso se desarrolla como una secuencia controlada de eventos electroquímicos.
Aplicando la corriente
En el momento en que se enciende la alimentación de CC, se establece un potencial eléctrico entre el ánodo y el cátodo. Esto crea un campo eléctrico en todo el baño electrolítico.
Migración de iones
Impulsadas por este campo eléctrico, las partículas cargadas (iones) en la solución comienzan a moverse. Los iones cargados positivamente, conocidos como cationes (por ejemplo, Cu²⁺), son atraídos al cátodo cargado negativamente (la pieza de trabajo).
La reacción de reducción en el cátodo
Este es el corazón del proceso de recubrimiento. Cuando los cationes alcanzan la superficie del cátodo, ganan electrones. Este proceso químico se llama reducción. Ganar electrones neutraliza su carga, lo que hace que se depositen en la superficie como una película de metal sólido.
Para el cobre, la reacción es: Cu²⁺ (en solución) + 2e⁻ → Cu (recubrimiento sólido)
La reacción de oxidación en el ánodo
Simultáneamente, una reacción correspondiente llamada oxidación ocurre en el ánodo, donde una sustancia pierde electrones. Si se utiliza un ánodo sacrificial, este se disuelve lentamente en el baño, reponiendo los iones metálicos que se depositaron en el cátodo y asegurando un proceso estable.
La reacción del ánodo de cobre sacrificial es: Cu (ánodo sólido) → Cu²⁺ (en solución) + 2e⁻
Comprendiendo las ventajas y desventajas
Aunque potente, la electrodeposición no es una solución universal. Comprender sus ventajas y limitaciones es fundamental para su correcta aplicación.
Ventaja: Precisión y uniformidad
La principal fortaleza de la electrodeposición es su capacidad para crear recubrimientos altamente uniformes, incluso en objetos con geometrías complejas, orificios y superficies internas. Este "poder de penetración" es difícil de lograr con métodos de línea de visión como la pintura en aerosol.
Ventaja: Fuerte adhesión
Debido a que el recubrimiento se forma a través de un enlace electroquímico a nivel atómico, la adhesión entre el sustrato y la capa depositada es excepcionalmente fuerte y duradera.
Limitación: Solo sustratos conductores
El proceso se basa fundamentalmente en que la pieza de trabajo sea capaz de conducir electricidad. Los materiales no conductores como plásticos o cerámicas no pueden recubrirse directamente sin antes ser tratados con una capa conductora.
Limitación: Preocupaciones ambientales y de seguridad
Muchos baños electrolíticos industriales contienen materiales peligrosos, como ácidos fuertes, metales pesados o cianuros. Esto requiere estrictos controles de proceso, tratamiento especializado de residuos y sólidos protocolos de seguridad para proteger a los trabajadores y el medio ambiente.
Tomar la decisión correcta para su objetivo
La decisión de utilizar la electrodeposición depende de su objetivo técnico específico.
- Si su enfoque principal es la resistencia a la corrosión: La electrodeposición es una excelente opción para aplicar capas protectoras como zinc (galvanizado) o níquel, que crean una barrera densa y no porosa contra los elementos.
- Si su enfoque principal es la estética o la conductividad: El proceso es ideal para acabados decorativos como cromo, oro y plata, o para aplicar capas altamente conductoras de cobre en la fabricación de productos electrónicos.
- Si su enfoque principal es recubrir formas complejas e intrincadas: La capacidad de la electrodeposición para cubrir uniformemente todas las superficies mojadas la hace superior a casi cualquier otro método para piezas con características internas o externas complejas.
Al dominar la interacción de la química y la electricidad, la electrodeposición ofrece un control inigualable para diseñar una superficie que satisfaga una necesidad específica.
Tabla resumen:
| Componente | Función en la electrodeposición |
|---|---|
| Baño electrolítico | Solución que contiene iones disueltos del material de recubrimiento. |
| Cátodo | El objeto a recubrir; atrae iones positivos. |
| Ánodo | Completa el circuito; puede ser sacrificial o inerte. |
| Fuente de energía | Proporciona la corriente continua (CC) para impulsar la reacción. |
| Consideración clave | Ventaja / Limitación |
|---|---|
| Uniformidad del recubrimiento | Excelente para formas complejas (Ventaja) |
| Adhesión | Fuerte, enlace a nivel atómico (Ventaja) |
| Sustrato | Requiere una superficie conductora (Limitación) |
| Proceso | Implica materiales peligrosos (Limitación) |
¿Listo para lograr recubrimientos de precisión en su laboratorio?
El proceso controlado de electrodeposición es esencial para aplicaciones que requieren capas metálicas uniformes, desde protección contra la corrosión hasta conductividad electrónica. KINTEK se especializa en proporcionar el equipo de laboratorio confiable y los consumibles que necesita para perfeccionar sus procesos de electrodeposición de manera segura y eficiente.
Contacte hoy a nuestros expertos para discutir cómo nuestras soluciones pueden mejorar las capacidades de su laboratorio y ayudarlo a alcanzar sus objetivos específicos de recubrimiento.
Guía Visual
Productos relacionados
- Equipo de sistema de máquina HFCVD para recubrimiento de nanodiamante de matriz de trefilado
- Sistema de Reactor de Deposición Química de Vapor de Plasma de Microondas de Máquina de Diamantes MPCVD de 915MHz
- Tamices de laboratorio y máquinas tamizadoras
- Blankos de Herramientas de Corte de Diamante CVD para Mecanizado de Precisión
- Electrodo de disco giratorio (disco de anillo) RRDE / compatible con PINE, ALS japonés, Metrohm suizo de carbono vítreo platino
La gente también pregunta
- ¿Cómo funcionan las celdas electrolíticas y los sistemas de control de potencial en la disolución selectiva electroquímica del platino?
- ¿Cuáles son las ventajas de utilizar un sistema de celda electrolítica de tres electrodos? Lograr una caracterización precisa de RuO2
- ¿Cómo facilitan las celdas electrolíticas la preparación de aleaciones de metales líquidos? Domina el éxito del aleado electroquímico
- ¿Qué medidas de seguridad se deben tomar al usar electrolitos corrosivos? Protección esencial para su laboratorio
- ¿Cuál es el procedimiento de limpieza de la celda electrolítica antes de usarla? Asegure resultados precisos y reproducibles
- ¿Cuáles son las ventajas de una celda electrolítica de vidrio cubierta de PTFE? Garantice la precisión en las pruebas saturadas de CO2
- ¿Cuál es la función de una celda electrolítica de membrana intercambiable tipo H? Dominar el control preciso de la reacción
- ¿Qué papel juegan los electrolizadores de sales fundidas en la síntesis de amoníaco? Impulsando el ciclo mediado por litio



















