No, el grafito no es un metal, pero es un excelente conductor eléctrico. Esta distinción es una fuente de confusión frecuente, ya que a menudo se nos enseña a asociar la conductividad exclusivamente con los elementos metálicos. El grafito es un alótropo —una forma estructural específica— del elemento no metálico carbono.
La razón principal de esta confusión es que tendemos a agrupar los materiales por categorías simples en lugar de por su estructura fundamental. El grafito, aunque no es un metal, conduce la electricidad porque su disposición atómica única en capas crea electrones "libres" que se comportan casi exactamente como los electrones en un verdadero metal.

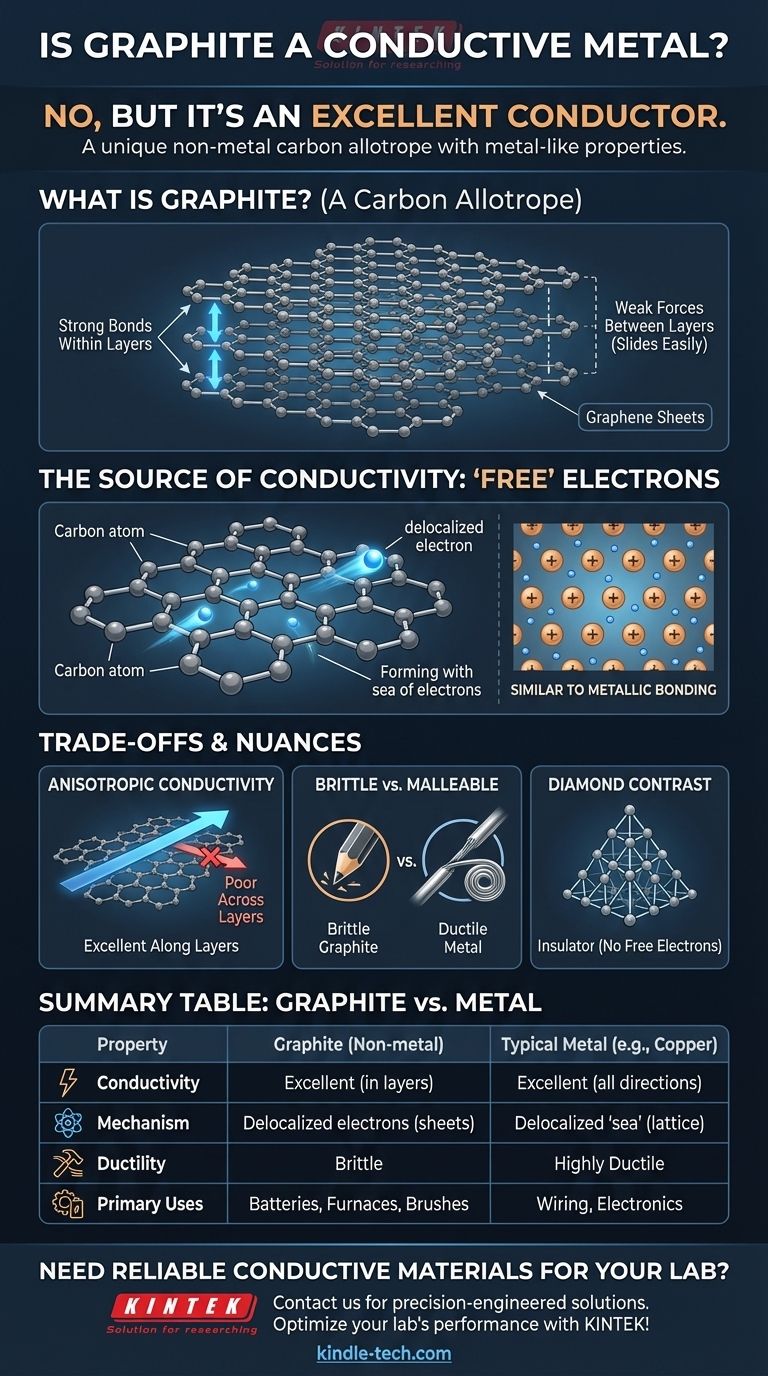
¿Qué es el grafito? Una forma única de carbono
Las propiedades del grafito surgen directamente de su estructura atómica única. Comprender esta estructura es clave para entender su comportamiento.
No es un metal, sino un alótropo
Los elementos pueden existir en diferentes formas físicas llamadas alótropos. Estas formas tienen los mismos átomos pero diferentes disposiciones estructurales, lo que les confiere propiedades muy diferentes.
El grafito es un alótropo del carbono. El otro alótropo más famoso del carbono es el diamante. Aunque ambos son carbono puro, sus estructuras hacen del grafito un conductor blando y del diamante un aislante duro.
Una estructura de capas apiladas
El grafito está compuesto por innumerables láminas planas apiladas una encima de la otra. Cada lámina, conocida como grafeno, es una capa de un átomo de espesor de átomos de carbono dispuestos en una red hexagonal similar a un panal.
Los enlaces que mantienen unidos los átomos dentro de una lámina son increíblemente fuertes. Sin embargo, las fuerzas que mantienen unidas las diferentes láminas entre sí son muy débiles, lo que les permite deslizarse fácilmente. Por eso el grafito es blando y escamoso, formando la "mina" de los lápices.
La fuente de la conductividad del grafito
La razón por la que el grafito conduce la electricidad radica en cómo se comparten sus electrones, o más bien, cómo no se comparten. Esto imita el mecanismo conductor de los metales sin que el grafito sea un metal en sí mismo.
El papel de los electrones del carbono
Cada átomo de carbono tiene cuatro electrones externos (electrones de valencia) disponibles para el enlace. En la estructura hexagonal de una lámina de grafeno, cada átomo de carbono forma fuertes enlaces covalentes con tres átomos vecinos.
El electrón deslocalizado "libre"
Esto deja uno de los cuatro electrones de valencia sin contabilizar. Este cuarto electrón no está bloqueado en un enlace entre dos átomos específicos. En cambio, se vuelve deslocalizado, libre de moverse por cualquier parte de su lámina de grafeno bidimensional.
Un "mar de electrones" en un no metal
Esta colección de electrones deslocalizados forma un "mar de electrones" móvil dentro de cada capa. Dado que una corriente eléctrica es simplemente el flujo de electrones, estos electrones de libre movimiento permiten que el grafito conduzca la electricidad con facilidad.
Esto es fundamentalmente similar al enlace metálico, donde una red de iones metálicos positivos se encuentra en un "mar" de electrones compartidos y deslocalizados. El grafito logra un resultado similar utilizando una estructura atómica completamente diferente.
Comprendiendo las compensaciones y los matices
Aunque el grafito es un conductor, no es un sustituto perfecto de los metales. Su naturaleza no metálica conlleva compensaciones distintas.
La conductividad no es uniforme
El grafito es altamente anisotrópico, lo que significa que sus propiedades dependen de la dirección. Conduce la electricidad extremadamente bien a lo largo de sus láminas de grafeno, pero muy mal a través de ellas. La mayoría de los metales, en contraste, son isotrópicos y conducen la electricidad igual de bien en todas las direcciones.
Fragilidad vs. Maleabilidad
Los metales son típicamente dúctiles y maleables, lo que significa que pueden estirarse en hilos o martillarse para darles nuevas formas sin romperse. El grafito es frágil y se romperá bajo una tensión similar. No se puede formar un hilo de grafito estirándolo.
Diamante: La contraparte aislante
El diamante proporciona el contraste perfecto. En su red rígida y tetraédrica, cada átomo de carbono se une a otros cuatro, utilizando los cuatro electrones de valencia. Sin electrones deslocalizados, no hay nada libre para moverse y transportar una corriente, lo que convierte al diamante en un excelente aislante eléctrico.
Tomando la decisión correcta para su aplicación
Comprender estos principios le permite seleccionar el material adecuado en función de las propiedades específicas requeridas para una tarea.
- Si su enfoque principal es la conductividad flexible y omnidireccional: Metales como el cobre y el aluminio siguen siendo la opción superior debido a su ductilidad y naturaleza isotrópica.
- Si su enfoque principal es un conductor ligero y químicamente estable para altas temperaturas: El grafito es un material ideal para aplicaciones como electrodos de batería, revestimientos de hornos y escobillas de motores eléctricos.
- Si su enfoque principal es la dureza y el aislamiento eléctrico: El diamante, el otro alótropo famoso del carbono, es la solución, demostrando que la disposición atómica lo dicta todo.
En última instancia, las propiedades de un material se definen por su estructura atómica, no por la simple categoría en la que lo colocamos.
Tabla resumen:
| Propiedad | Grafito | Metal Típico (ej. Cobre) |
|---|---|---|
| Tipo de Material | No metal (Alótropo de Carbono) | Metal |
| Conductividad Eléctrica | Excelente (dentro de las capas) | Excelente (en todas las direcciones) |
| Mecanismo de Conducción | Electrones deslocalizados en láminas de grafeno | 'Mar de electrones' deslocalizados |
| Ductilidad/Maleabilidad | Frágil, no se puede estirar en hilos | Altamente dúctil y maleable |
| Usos Principales | Baterías, revestimientos de hornos, escobillas de motor | Cableado, componentes estructurales, electrónica |
¿Necesita un material conductor fiable para su aplicación de laboratorio? Ya sea que esté trabajando con hornos de alta temperatura, investigación de baterías o configuraciones de electrodos personalizados, la experiencia de KINTEK en equipos y consumibles de laboratorio garantiza que obtenga la solución adecuada. Nuestro equipo puede ayudarle a seleccionar materiales que se ajusten a sus requisitos específicos de conductividad, temperatura y durabilidad. Contáctenos hoy para optimizar el rendimiento de su laboratorio con soluciones de ingeniería de precisión de KINTEK.
Guía Visual
Productos relacionados
- Electrodo Electrolítico de Grafito en Disco y Varilla de Grafito
- Placa de grafito de carbono fabricada por el método de prensado isostático
- Horno Vertical de Vacío de Grafito de Alta Temperatura para Grafización
- Horno de grafización de vacío de grafito vertical grande
- Horno Continuo de Grafización al Vacío de Grafito
La gente también pregunta
- ¿Cuáles son las características y aplicaciones de un electrodo de lámina de grafito? Maximizar el área de reacción para la electrólisis en masa
- ¿Por qué se selecciona una varilla de grafito de alta pureza como electrodo de contra para EIS? Garantizar la integridad de los datos y la estabilidad química
- ¿Cuál es la función principal de los electrodos de grafito de alta pureza en la lixiviación de CA? Potenciando la Recuperación Eficiente de Metales
- ¿Cuáles son las propiedades de las varillas de grafito? Aproveche la alta conductividad para aplicaciones extremas
- ¿Cómo se debe limpiar y almacenar un electrodo de grafito después de un experimento? Garantizar datos electroquímicos fiables



















