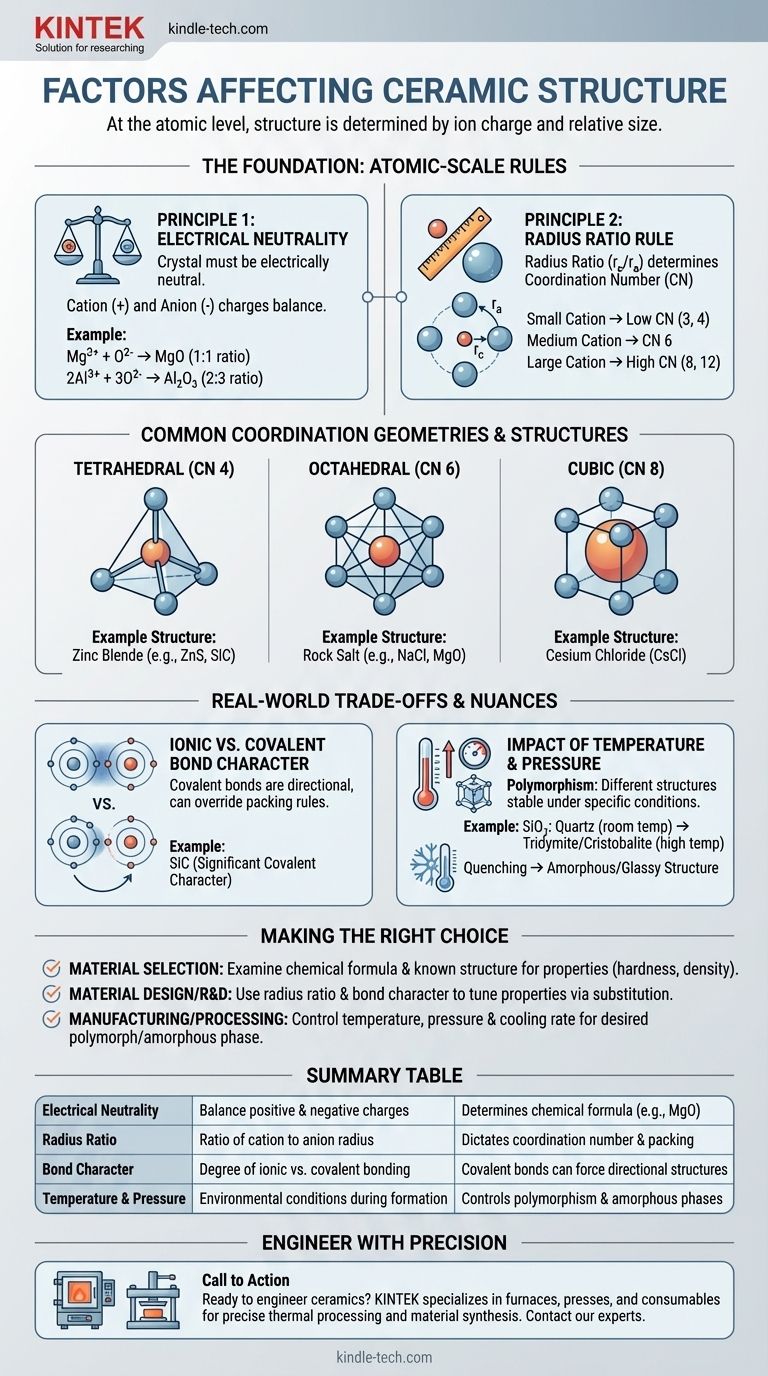
A nivel atómico, la estructura cristalina de una cerámica está determinada por dos factores principales: la carga eléctrica de sus iones constituyentes y el tamaño relativo de esos iones. Para formar una estructura estable y de baja energía, la disposición de los átomos debe satisfacer la neutralidad de carga al mismo tiempo que se empaqueta de la manera geométricamente más eficiente posible.
El desafío fundamental en la formación de cualquier estructura cristalina cerámica es equilibrar fuerzas contrapuestas. Los cationes y aniones se atraen, creando estructuras densas, pero sus tamaños relativos dictan la disposición geométrica específica —el número de coordinación— que se puede lograr físicamente manteniendo la neutralidad eléctrica general.
La Base: Reglas a Escala Atómica
Para entender por qué una cerámica como el óxido de magnesio (MgO) forma una estructura mientras que el carburo de silicio (SiC) forma otra, debemos comenzar con las dos reglas innegociables que rigen cómo los átomos se organizan en una red cristalina estable.
Principio 1: La Regla de la Neutralidad Eléctrica
El requisito más fundamental es que el cristal debe ser eléctricamente neutro. La suma de todas las cargas positivas de los cationes debe ser precisamente equilibrada por la suma de todas las cargas negativas de los aniones.
Este principio dicta la fórmula química en sí. Por ejemplo, dado que un ion de magnesio tiene una carga de +2 (Mg²⁺) y un ion de oxígeno tiene una carga de -2 (O²⁻), se combinan en una proporción de 1:1 para formar MgO. Un ion de aluminio (Al³⁺) y un ion de oxígeno (O²⁻) deben combinarse en una proporción de 2:3 para formar Al₂O₃ y lograr la neutralidad.
Principio 2: La Regla de la Relación de Radios
Una vez establecida la fórmula química, la geometría toma el control. La relación de radios —el radio del catión (r_c) dividido por el radio del anión (r_a)— es el factor crítico que determina el número de coordinación (NC).
El número de coordinación es simplemente el número de aniones que pueden empaquetarse alrededor de un catión central. Imagine intentar empaquetar balones de baloncesto (aniones) alrededor de una pelota de tenis más pequeña (catión). Solo puede caber unos pocos antes de que empiecen a tocarse. Si reemplaza la pelota de tenis por un balón de fútbol más grande, podrá colocar más balones de baloncesto a su alrededor. El tamaño relativo dicta la geometría de empaquetamiento.
Del Empaquetamiento Atómico a la Estructura Cristalina
Estos dos principios trabajan juntos para producir los patrones tridimensionales repetitivos que definen las estructuras cristalinas cerámicas. La relación de radios predice el número de coordinación, y la necesidad de neutralidad de carga dicta cómo estas unidades coordinadas se unen en el espacio.
Geometrías de Coordinación Comunes
Rangos específicos de relación de radios sugieren fuertemente un número de coordinación preferido y su forma correspondiente:
- Un catión pequeño resulta en un NC bajo, como 3 (triangular) o 4 (tetraédrico).
- Un catión de tamaño mediano permite un NC de 6 (octaédrico).
- Un catión grande, casi del tamaño del anión, puede alcanzar un NC de 8 (cúbico) o incluso 12.
Ejemplos de Estructuras Cerámicas Comunes
Estas reglas dan lugar a estructuras cristalinas bien conocidas, nombradas a partir de minerales comunes. Para cerámicas tipo AX simples (un catión, un anión):
- Estructura de Sal Gema (p. ej., NaCl, MgO): Presenta un número de coordinación de 6 tanto para el catión como para el anión. Es una estructura muy estable y común cuando el catión y el anión tienen una diferencia de tamaño moderada.
- Estructura de Cloruro de Cesio (CsCl): Ocurre cuando el catión es casi tan grande como el anión, permitiendo un número de coordinación de 8 más densamente empaquetado.
- Estructura de Blenda de Zinc (p. ej., ZnS, SiC): Se forma cuando el catión es significativamente más pequeño que el anión, lo que resulta en un número de coordinación de 4 (tetraédrico). Esta estructura también es característica de materiales con fuerte enlace covalente.
Para fórmulas más complejas como AₘXₚ (p. ej., Al₂O₃, CaF₂), se aplican los mismos principios. La estructura simplemente se convierte en una disposición más intrincada para asegurar que cada ion logre su coordinación preferida y la carga general permanezca neutra.
Comprendiendo las Ventajas y Limitaciones
Si bien estos principios proporcionan un marco poderoso, son un modelo simplificado. Los factores del mundo real introducen matices importantes que pueden alterar la estructura final.
El Carácter del Enlace Iónico vs. Covalente
La regla de la relación de radios funciona mejor para enlaces puramente iónicos. Sin embargo, muchas cerámicas, como el carburo de silicio (SiC) y el nitruro de silicio (Si₃N₄), tienen un carácter covalente significativo.
Los enlaces covalentes son altamente direccionales. Los átomos prefieren unirse en ángulos específicos (p. ej., 109.5° en un tetraedro). En estos materiales, la necesidad de satisfacer enlaces covalentes direccionales puede anular las reglas de empaquetamiento geométrico de la relación de radios, forzando una estructura específica como la coordinación tetraédrica.
El Impacto de la Temperatura y la Presión
Un solo compuesto químico a menudo puede existir en múltiples estructuras cristalinas diferentes, un fenómeno conocido como polimorfismo. Cada una de estas estructuras, o polimorfos, es estable bajo un rango específico de temperatura y presión.
Por ejemplo, la sílice (SiO₂) existe como cuarzo a temperatura ambiente, pero se transforma en otros polimorfos como la tridimita y la cristobalita a temperaturas más altas. Estas transformaciones implican una reorganización de los átomos en una nueva estructura más estable para esas condiciones.
Además, si una cerámica fundida se enfría muy rápidamente (enfriamiento brusco), es posible que los átomos no tengan tiempo suficiente para organizarse en una red cristalina ordenada. Esto da como resultado una estructura desordenada, amorfa o vítrea.
Tomando la Decisión Correcta para Su Aplicación
Comprender estos factores le permite conectar el procesamiento y la composición de una cerámica con su estructura final y, en última instancia, su rendimiento.
- Si su enfoque principal es la selección de materiales: Comience examinando la fórmula química y la estructura cristalina conocida. Una estructura densa y de alta coordinación como el corindón (Al₂O₃) implica alta dureza y densidad, mientras que una estructura de menor coordinación puede tener propiedades diferentes.
- Si su enfoque principal es el diseño de materiales o I+D: Utilice la relación de radios y el carácter del enlace como sus herramientas. La sustitución de átomos con diferentes tamaños o electronegatividad se puede utilizar para cambiar intencionalmente la estructura cristalina y ajustar sus propiedades.
- Si su enfoque principal es la fabricación y el procesamiento: Sus variables clave son la temperatura, la presión y la velocidad de enfriamiento. Úselas para controlar qué polimorfo se forma o para decidir entre un producto final cristalino y uno amorfo.
Al comprender la interrelación entre la carga, el tamaño y las condiciones de procesamiento, puede pasar de simplemente usar cerámicas a diseñarlas deliberadamente para un propósito específico.
Tabla Resumen:
| Factor | Descripción | Impacto Clave en la Estructura |
|---|---|---|
| Neutralidad Eléctrica | Las cargas positivas y negativas totales en el cristal deben equilibrarse. | Determina la fórmula química (p. ej., MgO, Al₂O₃). |
| Relación de Radios | La relación del radio del catión al radio del anión (r_c/r_a). | Dicta el número de coordinación y la geometría de empaquetamiento (p. ej., tetraédrica, octaédrica). |
| Carácter del Enlace | El grado de enlace iónico vs. covalente. | Los enlaces covalentes pueden forzar estructuras direccionales, anulando las reglas de empaquetamiento simples. |
| Temperatura y Presión | Las condiciones ambientales durante la formación y el procesamiento. | Controla el polimorfismo (diferentes formas cristalinas) y la formación de fases amorfas/vítreas. |
¿Listo para diseñar cerámicas con precisión? El equipo de laboratorio adecuado es fundamental para controlar los factores que definen la estructura y el rendimiento de su material. KINTEK se especializa en los hornos, prensas y consumibles que su laboratorio necesita para un procesamiento térmico y síntesis de materiales precisos. Contacte a nuestros expertos hoy mismo para discutir cómo nuestras soluciones pueden ayudarle a alcanzar sus objetivos específicos de materiales.
Guía Visual
Productos relacionados
- Lámina Cerámica de Carburo de Silicio (SiC) Resistente al Desgaste, Cerámica Avanzada Fina de Ingeniería
- Lámina de Cerámica de Nitruro de Silicio (SiN) Mecanizado de Precisión para Ingeniería de Cerámicas Finas Avanzadas
- Tamices de laboratorio y máquinas tamizadoras
- Bola de cerámica de circonio mecanizada de precisión para cerámica fina avanzada de ingeniería
- Disipador de calor de óxido de aluminio Al2O3 de cerámica avanzada de ingeniería para aislamiento
La gente también pregunta
- ¿Cómo funcionan los consumibles como el almidón o el serrín en las membranas cerámicas porosas? Guía experta sobre agentes formadores de poros
- ¿Cuánto calor puede soportar la porcelana? Descubra su verdadera resistencia al calor y evite el choque térmico
- ¿Aumenta la ductilidad la sinterización? Domine las compensaciones para un rendimiento óptimo del material
- ¿A qué temperatura se sinteriza la alúmina? Logre densidad y resistencia óptimas
- ¿Cuál es la función principal de los soportes cerámicos porosos? Garantizar la integridad estructural en membranas de zeolita
- ¿Por qué usar papel de nitruro de aluminio (AlN) para el sinterizado? Protección esencial para la síntesis de materiales de alta pureza
- ¿Cuál es la temperatura máxima de funcionamiento de la alúmina? El papel crítico de la pureza y la forma
- ¿Qué es la zirconia en aplicaciones biomédicas? Una cerámica biocompatible de alta resistencia para implantes



















