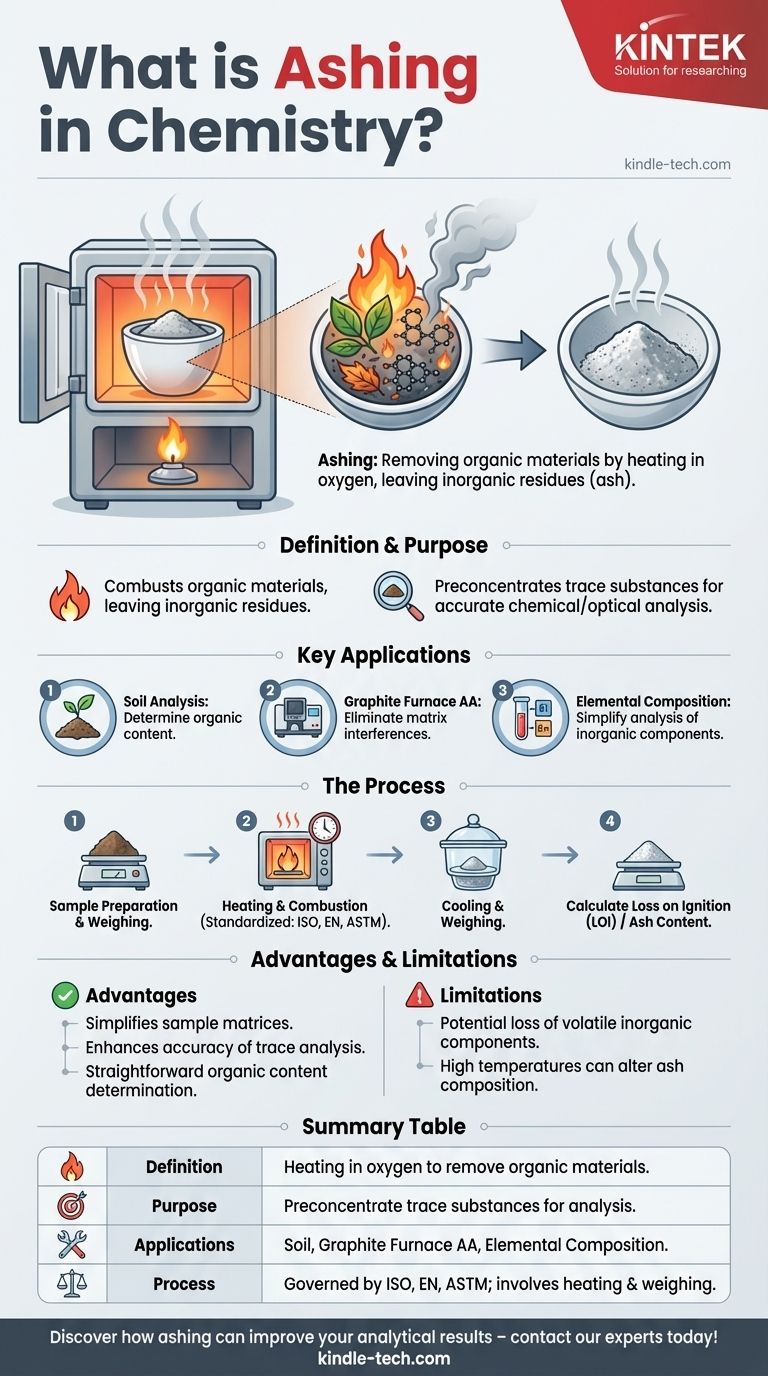
La calcinación en química es un proceso utilizado para eliminar materiales orgánicos de una muestra calentándola en presencia de oxígeno, dejando residuos inorgánicos no combustibles conocidos como cenizas. Esta técnica se utiliza ampliamente en química analítica para la preconcentración de sustancias traza, lo que permite un análisis más preciso de los componentes inorgánicos mediante métodos como la cromatografía o la espectroscopia. La calcinación también se emplea en el análisis de suelos para determinar el contenido orgánico y en programas de absorción atómica con horno de grafito (AA) para eliminar interferencias de la matriz. El proceso a menudo está estandarizado por protocolos internacionales como ISO, EN o ASTM, con aplicaciones que incluyen mediciones de pérdida por ignición (LOI).

Puntos clave explicados:
-
Definición y propósito de la calcinación:
- La calcinación es un proceso de mineralización que implica calentar una muestra en presencia de oxígeno para quemar materiales orgánicos, dejando residuos inorgánicos (cenizas).
- El propósito principal es preconcentrar sustancias traza para el posterior análisis químico u óptico, como la cromatografía o la espectroscopia.
-
Aplicaciones de la calcinación:
- Análisis de suelos: La calcinación se utiliza para determinar el contenido orgánico del suelo comparando la masa antes y después del proceso.
- AA con horno de grafito: En la espectroscopia de absorción atómica, la calcinación elimina los componentes de la matriz que podrían interferir con la medición del analito.
- Análisis de composición elemental: Al eliminar los materiales orgánicos, la calcinación simplifica el análisis de los componentes inorgánicos en una muestra.
-
Proceso de calcinación:
- Las muestras se calientan en el aire hasta que se queman, oxidando los compuestos orgánicos y dejando residuos inorgánicos no combustibles.
- El proceso a menudo se rige por estándares internacionales (p. ej., ISO, EN, ASTM) para garantizar la coherencia y la precisión.
- Objetivos específicos, como la pérdida por ignición (LOI), implican pesar las muestras antes y después de la calcinación para medir la reducción de masa.
-
Importancia en la química analítica:
- La calcinación es un paso crítico en la preparación de muestras para un análisis preciso, particularmente cuando se trata de matrices complejas.
- Mejora la sensibilidad y la precisión de las técnicas analíticas al eliminar sustancias interferentes.
-
Estandarización y protocolos:
- El proceso de calcinación a menudo se estandariza para garantizar la reproducibilidad y la fiabilidad en diferentes laboratorios.
- Los protocolos pueden especificar la temperatura, la duración y otros parámetros para lograr resultados consistentes.
-
Ventajas de la calcinación:
- Simplifica las matrices de las muestras, facilitando el análisis de los componentes inorgánicos.
- Mejora la precisión del análisis de elementos traza al eliminar las interferencias orgánicas.
- Proporciona un método sencillo para determinar el contenido orgánico en materiales como el suelo.
-
Limitaciones y consideraciones:
- El proceso puede resultar en la pérdida de componentes inorgánicos volátiles si no se controla cuidadosamente.
- Las altas temperaturas a veces pueden alterar la composición de las cenizas, lo que requiere una calibración y validación cuidadosas de los resultados.
Al comprender los principios y las aplicaciones de la calcinación, los químicos y analistas pueden utilizar eficazmente esta técnica para mejorar la precisión y la fiabilidad de sus resultados analíticos.
Tabla resumen:
| Aspecto | Detalles |
|---|---|
| Definición | Calentar una muestra en oxígeno para eliminar materiales orgánicos, dejando cenizas inorgánicas. |
| Propósito | Preconcentrar sustancias traza para un análisis químico u óptico preciso. |
| Aplicaciones | Análisis de suelos, AA con horno de grafito, análisis de composición elemental. |
| Proceso | Regido por estándares ISO, EN o ASTM; implica calentar y pesar muestras. |
| Ventajas | Simplifica matrices, elimina interferencias y determina el contenido orgánico. |
| Limitaciones | Posible pérdida de componentes volátiles; las altas temperaturas pueden alterar las cenizas. |
Descubra cómo la calcinación puede mejorar sus resultados analíticos: contacte hoy mismo a nuestros expertos!
Guía Visual
Productos relacionados
- Horno de Mufla de 1200℃ para Laboratorio
- Horno de mufla de 1400 ℃ para laboratorio
- Horno Tubular de Laboratorio de Alta Temperatura de 1700℃ con Tubo de Alúmina
- Horno de grafito al vacío para material negativo Horno de grafiación
- Horno de grafización al vacío de grafito de alta temperatura horizontal
La gente también pregunta
- ¿Cuál es el papel de un horno de laboratorio en la preparación de catalizadores de papel de carbono? Estabilizar eficazmente los precursores de níquel
- ¿Qué tan caliente se pone un horno en grados Celsius? De 1100°C a 1800°C para las necesidades de su laboratorio
- ¿Cuáles son las funciones principales de un horno de caja de alta temperatura de laboratorio en experimentos de interacción de refrigerante de metales pesados?
- ¿Cuáles son los objetivos específicos del tratamiento térmico de 900 °C para LAGP? Optimización del rendimiento del vitrocerámico
- ¿Cuáles son las aplicaciones del método de calcinación en seco? Una guía para el análisis del contenido mineral
- ¿Cuál es la función de un horno de alta temperatura en la producción de óxido de tierras raras? Lograr la estabilidad de materiales de alta pureza
- ¿Qué métodos se pueden seguir para evitar salpicaduras al determinar la ceniza? Asegure resultados precisos y confiables
- ¿Por qué se requiere un horno mufla para recubrimientos de TiO2 en aleaciones dentales? Desbloquea la biocompatibilidad y durabilidad



















