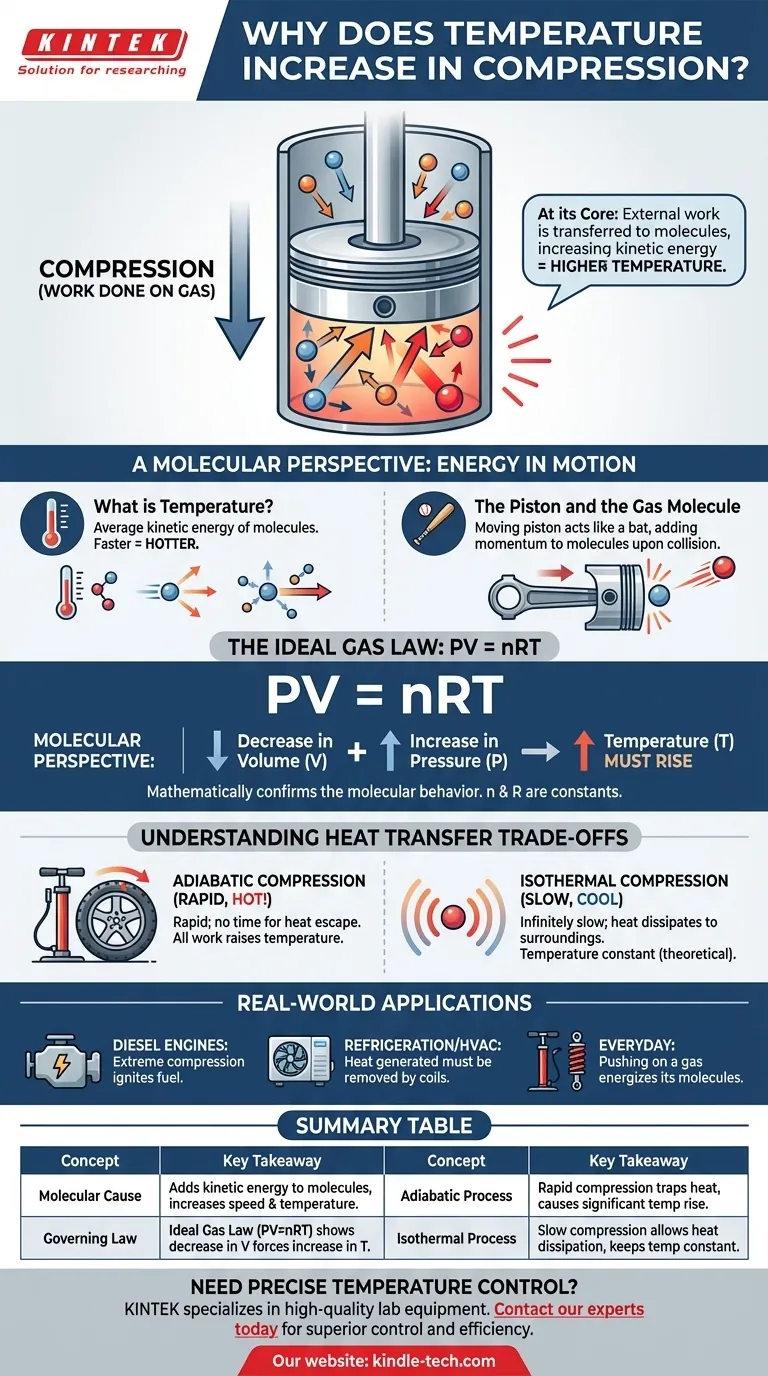
En esencia, comprimir un gas aumenta su temperatura porque se está realizando un trabajo sobre él. Este trabajo externo se transfiere directamente a las moléculas del gas, aumentando su energía cinética. Medimos este aumento en la energía cinética promedio de las moléculas como un aumento de la temperatura.
El acto de compresión no es simplemente una reducción de volumen; es una inyección de energía. La fuerza que se aplica para comprimir el gas añade energía a sus moléculas, haciéndolas moverse más rápido, lo que percibimos como calor.

Una perspectiva molecular: energía en movimiento
Para comprender realmente el calentamiento por compresión, debemos pensar en lo que sucede a escala de las moléculas individuales. La temperatura de un gas es simplemente una medida del movimiento promedio de sus innumerables partículas.
¿Qué es realmente la temperatura?
La temperatura es una medida macroscópica de la energía cinética promedio de las moléculas en un sistema. Las moléculas que se mueven más rápido poseen más energía cinética, lo que resulta en una temperatura más alta. Las moléculas que se mueven más lentamente significan una temperatura más baja.
El acto de compresión
Imagine un gas contenido dentro de un cilindro con un pistón móvil. Para comprimir el gas, debe empujar físicamente el pistón hacia adentro, aplicando fuerza a lo largo de una distancia. Esta acción es la definición científica de trabajo.
El pistón y la molécula de gas
Piense en el pistón en movimiento como un bate y en una molécula de gas como una pelota. Cuando una molécula choca con un pistón estacionario, rebota con la misma velocidad. Sin embargo, cuando choca con un pistón que se mueve hacia adentro, el pistón añade momento y energía a la molécula, haciendo que rebote con mayor velocidad.
El efecto colectivo
Esta transferencia de energía ocurre miles de millones de veces por segundo con todas las moléculas golpeando la cara del pistón. Cada colisión añade una pequeña cantidad de energía. El resultado acumulativo es un aumento significativo en la velocidad promedio, y por lo tanto en la energía cinética promedio, de toda la población de moléculas, lo que hace que la temperatura del gas aumente.
El papel de la Ley de los Gases Ideales
Este comportamiento molecular se describe matemáticamente mediante leyes físicas fundamentales, más sencillamente mediante la Ley de los Gases Ideales. Proporciona una confirmación de alto nivel de lo que vemos a nivel molecular.
La ecuación rectora: PV = nRT
La Ley de los Gases Ideales relaciona la presión (P), el volumen (V) y la temperatura (T) de una cantidad dada de gas (n). La 'R' es una constante. Esta ecuación muestra que estas propiedades están intrínsecamente vinculadas.
Cómo la ley predice el resultado
Cuando comprime un gas, disminuye su volumen (V). La fuerza que aplica también aumenta su presión (P). Para que la ecuación PV = nRT permanezca equilibrada, un aumento en el lado izquierdo de la ecuación (por la combinación del aumento de P y la disminución de V) debe ser compensado por un aumento en el lado derecho. Dado que n y R son constantes, la temperatura (T) debe aumentar.
Comprender las compensaciones: transferencia de calor
La velocidad de compresión cambia drásticamente el resultado porque determina cuánto tiempo tiene el sistema para interactuar con su entorno.
Compresión adiabática (sin escape de calor)
Esto ocurre cuando la compresión es tan rápida que no hay tiempo para que el calor generado escape al medio ambiente. Todo el trabajo que realiza se convierte directamente en el aumento de la energía interna y la temperatura del gas. Bombear un neumático de bicicleta es un ejemplo cercano en el mundo real; la bomba se calienta notablemente.
Compresión isotérmica (escape de calor perfecto)
Este es un ideal teórico que ocurre cuando la compresión se realiza infinitamente despacio. Este ritmo lento permite que todo el calor adicional generado por el trabajo se disipe en el entorno, manteniendo constante la temperatura del gas. Aunque no es prácticamente alcanzable, es un concepto crítico para el análisis termodinámico.
El escenario del mundo real
Casi todos los procesos del mundo real se encuentran entre estos dos extremos. Parte del trabajo realizado aumenta la temperatura interna, mientras que parte del calor generado se pierde en el medio ambiente.
Cómo aplicar este principio
Comprender el calentamiento por compresión no es solo académico; es fundamental para innumerables aplicaciones y sistemas del mundo real.
- Si su enfoque principal son los fenómenos cotidianos: Recuerde que empujar un gas (realizar trabajo) energiza sus moléculas, razón por la cual una bomba de bicicleta o un amortiguador se calientan.
- Si su enfoque principal es el diseño de motores: Este principio es la base misma del motor diésel, que utiliza una compresión extrema para calentar el aire lo suficiente como para encender el combustible sin bujía.
- Si su enfoque principal es la refrigeración o el HVAC: El calor generado durante la fase de compresión de un refrigerante es el calor residual que debe ser eliminado activamente por las serpentinas del condensador en la parte trasera de su refrigerador o en su unidad de aire acondicionado exterior.
En última instancia, el vínculo entre el trabajo mecánico y la energía térmica es una ley fundamental de la física, que convierte la fuerza en calor a nivel molecular.
Tabla de resumen:
| Concepto | Conclusión clave |
|---|---|
| Causa molecular | La compresión añade energía cinética a las moléculas de gas, aumentando su velocidad y temperatura. |
| Ley rectora | La Ley de los Gases Ideales (PV=nRT) muestra matemáticamente que una disminución del volumen (V) obliga a un aumento de la temperatura (T). |
| Proceso adiabático | La compresión rápida (p. ej., bomba de bicicleta) atrapa el calor, provocando un aumento significativo de la temperatura. |
| Proceso isotérmico | La compresión lenta y teórica permite que el calor se disipe, manteniendo la temperatura constante. |
| Impacto en el mundo real | Fundamental para los motores diésel, los ciclos de refrigeración y los sistemas HVAC. |
¿Necesita un control preciso de la temperatura para sus procesos? Los principios de la termodinámica son críticos para la I+D y las aplicaciones industriales. KINTEK se especializa en equipos y consumibles de laboratorio de alta calidad, satisfaciendo las exigentes necesidades de los laboratorios. Ya sea que esté desarrollando nuevos materiales u optimizando sistemas térmicos, nuestra experiencia puede respaldar su trabajo. Póngase en contacto con nuestros expertos hoy mismo para analizar cómo podemos ayudarle a lograr un control y una eficiencia superiores en su laboratorio.
Guía Visual
Productos relacionados
- Prensa Isostática en Caliente WIP Estación de Trabajo 300Mpa para Aplicaciones de Alta Presión
- Prensa de Calentamiento de Doble Placa para Laboratorio
- Molde de Prensado Antirrotura para Uso en Laboratorio
- Máquina de Prensado de Tabletas de Golpe Único y Máquina de Prensado de Tabletas Rotativa de Producción Masiva para TDP
- Máquina Prensadora Eléctrica de Tabletas de un Solo Punzón Prensa TDP para Polvo de Laboratorio
La gente también pregunta
- ¿Cuál es el propósito del recubrimiento por pulverización catódica? Lograr precisión y uniformidad a escala atómica
- ¿Cuáles son los productos obtenidos por pirólisis? Una guía sobre el biocarbón, el bioaceite y el gas de síntesis
- ¿Qué significa "sputtering" en los negocios? Un proceso de fabricación estratégico para la ventaja competitiva
- ¿Qué es la tubería de condensación? Evite costosos paros del sistema HVAC y daños por agua
- ¿Cuáles son los requisitos para las plantillas de espuma polimérica para cerámicas de fase MAX reticulada? Garantizar la integridad estructural
- ¿Por qué se requiere un sistema de reacción de alto sellado para la evaluación de la corrosión? Detener el ciclo de oxidación-cloración
- ¿Cuál es la diferencia entre biomasa y energía de biomasa? Desbloquee el poder de los recursos renovables
- ¿Cómo afecta la sinterización a la porosidad? Domine el proceso térmico para una densidad de material precisa



















