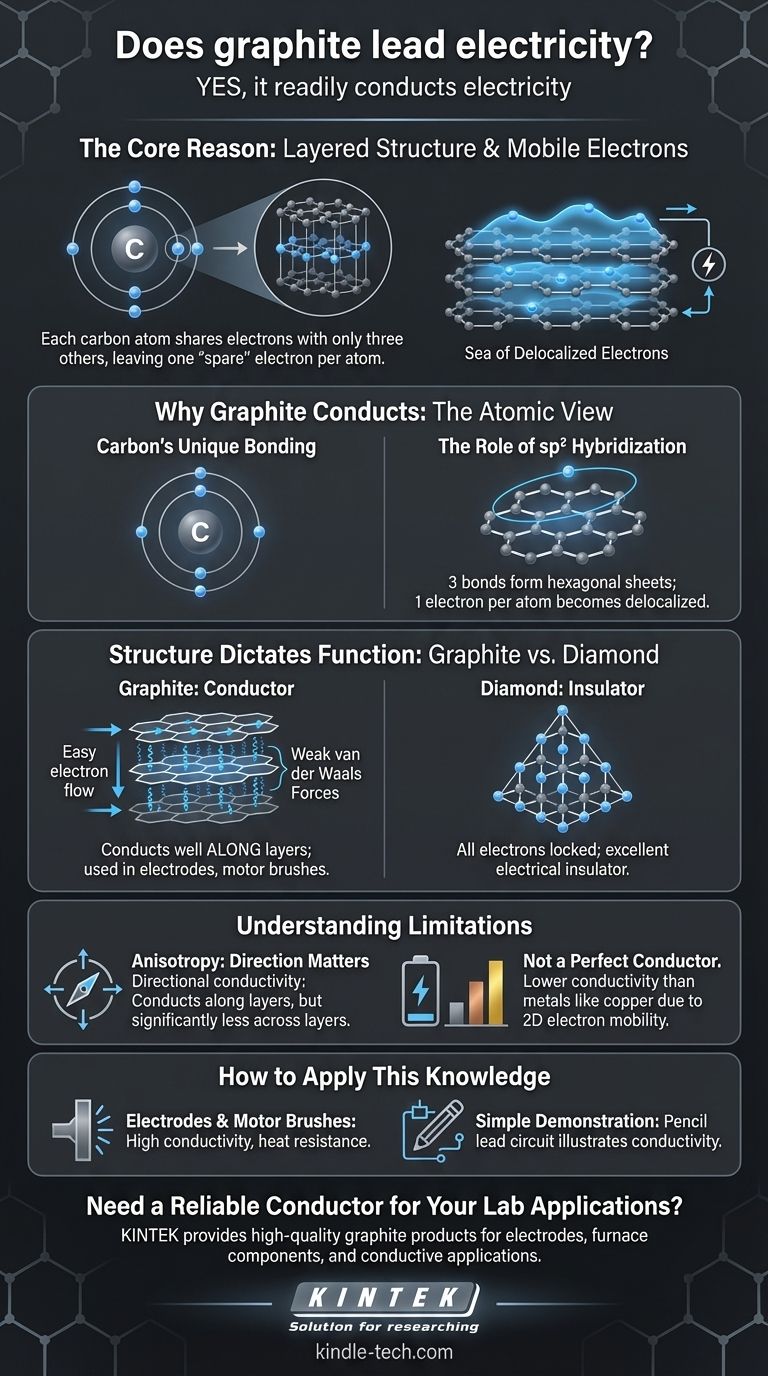
Sí, el grafito conduce la electricidad fácilmente. Es uno de los pocos no metales que es un conductor eléctrico eficaz, una propiedad que deriva directamente de su estructura atómica única y el comportamiento de sus electrones.
La razón principal por la que el grafito conduce la electricidad es su estructura en capas. Cada átomo de carbono comparte electrones con solo otros tres átomos, dejando un electrón por átomo libre para moverse a lo largo de estas capas, creando un "mar" de electrones móviles que pueden transportar una corriente eléctrica.

Por qué el grafito conduce la electricidad: la visión atómica
Para comprender la conductividad del grafito, debemos observar cómo se organizan y unen sus átomos de carbono. La explicación reside en un concepto llamado deslocalización de electrones.
El enlace único del carbono
Un átomo de carbono tiene cuatro electrones en la capa externa (electrones de valencia) disponibles para el enlace. En muchos compuestos de carbono, como el metano o el diamante, los cuatro de estos electrones forman enlaces fuertes y localizados.
El papel de la hibridación sp2
En el grafito, sin embargo, cada átomo de carbono utiliza solo tres de sus cuatro electrones de valencia para formar enlaces covalentes fuertes con tres átomos vecinos. Esta disposición, conocida como hibridación sp2, crea una red hexagonal plana, muy parecida a la malla de gallinero.
Un "mar" de electrones deslocalizados
Esto deja un electrón por átomo de carbono sin unir. Estos electrones "extra" no están confinados entre dos átomos específicos; en cambio, se deslocalizan, formando una nube de electrones de libre movimiento a través de todo el plano de la lámina hexagonal. Cuando se aplica un voltaje, estos electrones móviles fluyen, creando una corriente eléctrica.
La estructura dicta la función: grafito vs. diamante
El contraste entre el grafito y el diamante, ambas formas puras de carbono, proporciona la ilustración más clara de cómo la estructura atómica determina las propiedades eléctricas.
La red en capas del grafito
El grafito es esencialmente láminas apiladas de estas capas hexagonales de carbono (ahora conocidas como grafeno). Los electrones deslocalizados se mueven con facilidad a lo largo de estas capas, lo que hace que el grafito sea altamente conductor en esa dirección.
Las capas en sí están unidas por fuerzas mucho más débiles (fuerzas de van der Waals), razón por la cual el grafito se siente resbaladizo y se usa como lubricante.
La fortaleza rígida del diamante
En un diamante, cada átomo de carbono utiliza sus cuatro electrones de valencia para unirse con otros cuatro átomos de carbono en una red tetraédrica tridimensional rígida. Esto se conoce como hibridación sp3.
Debido a que todos los electrones están confinados en enlaces covalentes fuertes y localizados, no hay electrones móviles para transportar una corriente. Esto convierte al diamante en un excelente aislante eléctrico.
Comprendiendo las limitaciones
Aunque el grafito es un conductor, sus propiedades no son uniformes y no se comporta exactamente como un metal típico.
Anisotropía: la dirección importa
El grafito es un conductor anisotrópico. Esto significa que su conductividad es direccional. Conduce la electricidad extremadamente bien a lo largo de sus capas, pero es significativamente menos conductor a través de las capas. Los enlaces débiles entre las capas actúan como una barrera para el flujo de electrones.
No es un conductor perfecto
Aunque es un buen conductor para un no metal, su conductividad es generalmente menor que la de metales como el cobre, la plata o el oro. Esto se debe a que los metales tienen un mar tridimensional de electrones, mientras que la movilidad de los electrones del grafito es principalmente bidimensional.
Cómo aplicar este conocimiento
Comprender las propiedades del grafito permite su uso en una amplia gama de aplicaciones, desde lápices cotidianos hasta electrónica de alta tecnología.
- Si su enfoque principal es la creación de electrodos o escobillas de motor: La combinación de alta conductividad, resistencia al calor y propiedades autolubricantes del grafito lo convierte en una opción ideal.
- Si su enfoque principal está en materiales avanzados: Reconozca que una sola capa de grafito es grafeno, un material con propiedades eléctricas y mecánicas extraordinarias a nanoescala.
- Si su enfoque principal es una simple demostración de conductividad: Una "mina" de lápiz común (que es una mezcla de grafito y arcilla) se puede usar para dibujar un circuito conductor en papel, ilustrando el principio de una manera segura y accesible.
En última instancia, el grafito es un ejemplo perfecto de cómo la disposición atómica de un material dicta su función en el mundo real.
Tabla resumen:
| Propiedad | Grafito | Diamante |
|---|---|---|
| Conductividad Eléctrica | Buen Conductor (a lo largo de las capas) | Excelente Aislante |
| Enlace Atómico | Hibridación sp2 (3 enlaces) | Hibridación sp3 (4 enlaces) |
| Comportamiento de los Electrones | Electrones deslocalizados se mueven a lo largo de las capas | Todos los electrones están confinados en enlaces |
| Estructura | Láminas hexagonales en capas | Red tetraédrica rígida, 3D |
¿Necesita un conductor fiable para sus aplicaciones de laboratorio?
Las propiedades únicas del grafito lo convierten en un material esencial para electrodos, componentes de hornos y otras aplicaciones conductivas de alta temperatura.
En KINTEK, nos especializamos en proporcionar equipos y consumibles de laboratorio de alta calidad, incluidos productos de grafito adaptados para satisfacer las rigurosas demandas de su laboratorio. Nuestra experiencia garantiza que obtenga los materiales adecuados para un control preciso de la temperatura, un calentamiento uniforme y un rendimiento duradero.
Mejore la eficiencia y fiabilidad de su laboratorio—contacte hoy mismo a nuestros expertos para encontrar la solución perfecta para sus necesidades.
Guía Visual
Productos relacionados
- Placa de grafito de carbono fabricada por el método de prensado isostático
- Horno Vertical de Vacío de Grafito de Alta Temperatura para Grafización
- Bote de grafito de carbono - Horno de tubo de laboratorio con tapa
- Horno de grafización de vacío de grafito vertical grande
- Horno Continuo de Grafización al Vacío de Grafito
La gente también pregunta
- ¿Cómo pueden diferentes materiales tener diferente capacidad calorífica? Desvelando los Secretos Microscópicos del Almacenamiento de Energía
- ¿Cuáles son las ventajas de la biomasa? Desbloquee energía renovable a partir de residuos y cultivos
- ¿Cuáles son los tres tipos de recubrimiento? Una guía para recubrimientos arquitectónicos, industriales y de propósito especial
- ¿Cuáles son las propiedades del grafito? Desbloquea la resistencia a altas temperaturas y la conductividad
- ¿Qué papel juega la convección en la transferencia de calor? Entendiendo el movimiento del calor en los fluidos



















