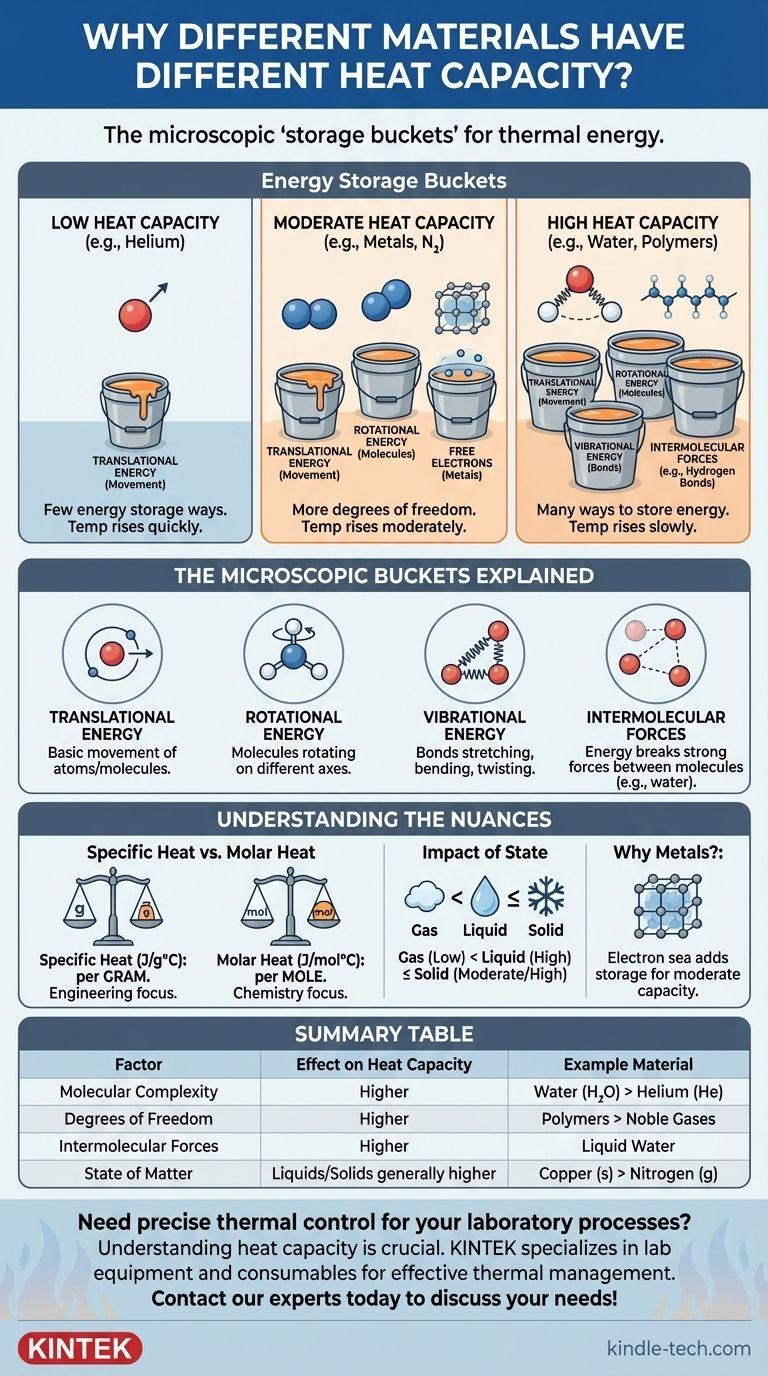
En esencia, la capacidad calorífica de un material está determinada por el número de formas en que puede almacenar energía térmica a nivel microscópico. Cuando se añade calor, esa energía no solo hace que los átomos se muevan más rápido; se distribuye en varios "contenedores de almacenamiento", como las rotaciones y vibraciones moleculares. Los materiales con estructuras más complejas tienen más de estos contenedores de almacenamiento, por lo que requieren más energía para lograr el mismo aumento de temperatura.
La conclusión clave es esta: la capacidad calorífica es una medida de la complejidad y libertad molecular. Los materiales con átomos simples (como los gases nobles) tienen baja capacidad calorífica, mientras que los materiales con moléculas complejas y fuertes fuerzas intermoleculares (como el agua) tienen alta capacidad calorífica porque tienen muchas más formas de absorber energía más allá del simple movimiento.

¿Qué es realmente la capacidad calorífica?
Para entender las diferencias entre materiales, primero debemos separar los conceptos de calor y temperatura.
Temperatura vs. Calor
La temperatura es una medida de la energía cinética promedio de las partículas en una sustancia. Piense en ella como la velocidad promedio de los átomos o moléculas mientras se mueven, se agitan y vibran.
El calor, por otro lado, es la energía térmica total transferida hacia o desde una sustancia. Cuando se añade calor, se está añadiendo energía. El trabajo de esa energía es elevar la energía interna total de la sustancia.
La analogía del "almacenamiento de energía"
Imagine que tiene varios cubos vacíos. Añadir calor es como verter agua en ellos. La temperatura es como el nivel del agua en solo uno de esos cubos, el etiquetado como "Movimiento" (energía cinética).
La capacidad calorífica de un material está determinada por la cantidad total de cubos que tiene. Si un material solo tiene un cubo ("Movimiento"), toda el agua que vierta irá allí, y el nivel subirá rápidamente. Si un material tiene muchos cubos, tendrá que verter mucha más agua para elevar el nivel en ese cubo específico de "Movimiento".
Los cubos microscópicos: donde se almacena la energía
Diferentes materiales tienen diferentes tipos de "cubos" microscópicos, formalmente conocidos como grados de libertad. Cada uno proporciona una forma diferente de almacenar energía térmica.
1. Energía traslacional (El cubo básico)
Esta es la energía de un átomo o molécula que se mueve de un lugar a otro. Todos los materiales la tienen. Es el principal contribuyente a lo que medimos como temperatura.
Para una sustancia simple como el gas helio, cuyos átomos son esferas individuales, esta es casi la única forma de almacenar energía. Su capacidad calorífica es muy baja.
2. Energía rotacional (Para moléculas)
Un solo átomo no puede rotar significativamente para almacenar energía, pero una molécula sí. Una molécula simple de dos átomos como el nitrógeno (N₂) puede girar sobre dos ejes diferentes, como una batuta girando.
Una molécula más compleja y no lineal como el agua (H₂O) puede girar sobre tres ejes diferentes. Cada eje de rotación es otro "cubo" para almacenar energía, aumentando su capacidad calorífica.
3. Energía vibracional (Un diferenciador clave)
Los enlaces que mantienen unidos a los átomos en una molécula no son varillas rígidas; son más bien como resortes. Pueden estirarse, doblarse y torcerse. Cada uno de estos modos vibracionales es otro cubo de energía altamente efectivo.
Una molécula diatómica simple tiene un modo vibracional. Una molécula compleja con muchos átomos y enlaces tiene docenas. Esta es una razón principal por la que las sustancias complejas como los aceites y los polímeros tienen capacidades caloríficas más altas que los gases simples.
4. Fuerzas intermoleculares (El ejemplo del agua)
En líquidos y sólidos, la energía también se utiliza para trabajar contra las fuerzas entre las moléculas. El agua es el ejemplo definitivo de esto. Sus moléculas están unidas por fuertes enlaces de hidrógeno.
Antes de que las moléculas de agua puedan acelerarse significativamente (aumentar la temperatura), una gran parte de la energía térmica añadida debe primero ir a sacudir y romper estos poderosos enlaces. Esto actúa como un enorme sumidero de energía, lo que le da al agua una de las capacidades caloríficas específicas más altas de cualquier sustancia común.
Comprendiendo los matices
Al comparar materiales, el contexto es crítico. Simplemente mirar un número puede ser engañoso sin entender lo que representa.
Calor específico vs. Capacidad calorífica molar
La capacidad calorífica específica es la energía requerida para elevar un gramo de una sustancia en un grado Celsius (J/g°C). Esto es útil para la ingeniería y aplicaciones del mundo real donde la masa es la principal preocupación.
La capacidad calorífica molar es la energía necesaria para elevar un mol de una sustancia en un grado (J/mol°C). Esto es a menudo más útil para físicos y químicos, ya que compara un número igual de moléculas, proporcionando una comparación más justa de la complejidad molecular. Por ejemplo, el calor específico del agua es más de cuatro veces el del cobre, pero su capacidad calorífica molar es solo unas tres veces mayor.
El impacto del estado (gas, líquido, sólido)
La capacidad calorífica de una sustancia cambia según su estado.
- Los gases tienen capacidades caloríficas más bajas porque sus moléculas están muy separadas y no interactúan mucho.
- Los líquidos tienen capacidades más altas debido a la energía necesaria para superar las fuerzas intermoleculares.
- Los sólidos almacenan energía en una red colectiva de vibraciones (llamadas fonones). Su capacidad es a menudo similar a su forma líquida, pero puede ser menor a temperaturas muy frías.
Por qué los metales tienen una capacidad calorífica moderada
Podría esperarse que los metales, al ser átomos simples, tuvieran una baja capacidad calorífica. Su capacidad es moderada debido a su estructura única: una red rígida de iones dentro de un "mar" de electrones de libre movimiento. Este mar de electrones también puede absorber energía térmica, actuando como un cubo de almacenamiento de energía adicional que los gases atómicos simples no tienen.
Tomando la decisión correcta para su objetivo
Cómo interprete los datos de capacidad calorífica depende enteramente de su objetivo.
- Si su enfoque principal es la ingeniería o la gestión térmica: Utilice la capacidad calorífica específica (por gramo), ya que informa directamente cuánto se calentará una masa dada de material en un diseño del mundo real.
- Si su enfoque principal es la química o física fundamental: Compare la capacidad calorífica molar (por mol) para aislar los efectos de la estructura molecular, los grados de libertad y los enlaces en el almacenamiento de energía.
- Si su enfoque principal es la ciencia del clima o la biología: Reconozca que la capacidad calorífica específica excepcionalmente alta del agua, impulsada por los enlaces de hidrógeno, es el factor más importante para estabilizar el clima de la Tierra y moderar la temperatura corporal en los organismos vivos.
En última instancia, la capacidad calorífica de un material es la firma macroscópica de su mundo microscópico.
Tabla resumen:
| Factor | Efecto en la capacidad calorífica | Material de ejemplo |
|---|---|---|
| Complejidad molecular | Moléculas más complejas = mayor capacidad | Agua (H₂O) vs. Helio (He) |
| Grados de libertad | Más formas de almacenar energía (rotación, vibración) = mayor capacidad | Polímeros vs. Gases nobles |
| Fuerzas intermoleculares | Fuerzas más fuertes (p. ej., enlaces de hidrógeno) = mayor capacidad | Agua líquida |
| Estado de la materia | Líquidos/Sólidos generalmente más altos que los gases | Cobre (sólido) vs. Nitrógeno (gas) |
| Electrones libres | El mar de electrones en los metales añade capacidad moderada | Metales como el aluminio |
¿Necesita un control térmico preciso para sus procesos de laboratorio? Comprender la capacidad calorífica es crucial para aplicaciones como la síntesis química, las pruebas de materiales y el análisis térmico. KINTEK se especializa en equipos y consumibles de laboratorio, proporcionando las herramientas que necesita para gestionar la energía térmica de manera efectiva. Ya sea que requiera hornos, calentadores o sistemas de monitoreo de temperatura, nuestras soluciones están diseñadas para la precisión y la fiabilidad. Contacte hoy mismo a nuestros expertos para discutir cómo podemos apoyar sus necesidades específicas de laboratorio y mejorar los resultados de su investigación.
Guía Visual
Productos relacionados
- Placas Cerámicas Especiales de Alúmina Zirconia Hechas a Medida para la Ingeniería Avanzada de Procesamiento de Cerámicas Finas
- Disipador de calor corrugado plano de cerámica de carburo de silicio (SiC) para cerámica fina avanzada de ingeniería
- Láminas de metal de oro, platino y cobre de alta pureza
- Crisol de grafito puro de alta pureza para evaporación
- Espuma de cobre
La gente también pregunta
- ¿Cuáles son las desventajas y ventajas del titanio? Sopesando el rendimiento frente al costo para su proyecto
- ¿Cuántos tipos de técnicas de endurecimiento existen? Explicación de una estrategia de seguridad multicapa
- ¿Cuáles son las fortalezas del braseado? Lograr una unión metálica fuerte, limpia y precisa
- ¿Cuál es la diferencia entre el recubrimiento metálico y el no metálico? Una guía sobre la protección sacrificial vs. de barrera
- ¿Cuál es la principal diferencia entre soldadura blanda y soldadura fuerte? Elija el método de unión de metales adecuado













