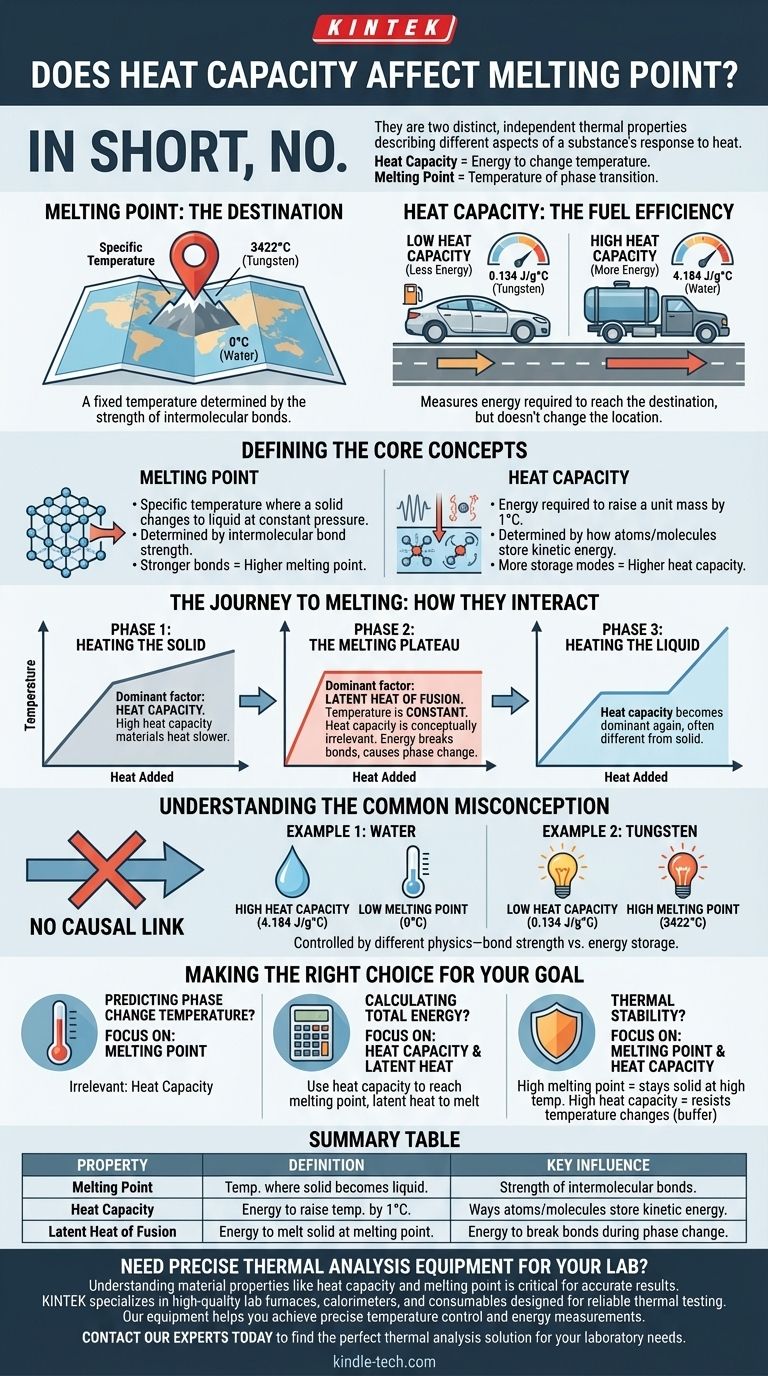
En resumen, no. La capacidad calorífica no afecta ni determina directamente el punto de fusión de un material. Son dos propiedades térmicas distintas e independientes que describen diferentes aspectos de la respuesta de una sustancia al calor. La capacidad calorífica mide la energía requerida para cambiar la temperatura de un material, mientras que el punto de fusión es la temperatura específica a la que transita de sólido a líquido.
Piense en el punto de fusión de un material como un destino fijo en un mapa (una temperatura específica). La capacidad calorífica, en contraste, es como la eficiencia del combustible del automóvil que está usando para llegar allí. Un automóvil con poca eficiencia de combustible (alta capacidad calorífica) requiere más combustible (energía) para llegar al destino, pero la ubicación del destino en sí no cambia.

Definiendo los conceptos centrales
Para entender por qué estas propiedades están separadas, primero debemos definirlas claramente. Describen diferentes fenómenos físicos a nivel molecular.
¿Qué es el punto de fusión?
El punto de fusión es la temperatura específica a la que un sólido cristalino puro, a presión constante, se transforma en líquido.
Esta temperatura está determinada por la fuerza de los enlaces intermoleculares que mantienen unidos los átomos o moléculas en una red cristalina fija.
Para fundir una sustancia, debe proporcionar suficiente energía para superar estas fuerzas. Por lo tanto, los materiales con enlaces más fuertes requieren más energía y tienen un punto de fusión más alto.
¿Qué es la capacidad calorífica?
La capacidad calorífica específica es la cantidad de energía térmica requerida para elevar la temperatura de una unidad de masa de una sustancia en un grado (por ejemplo, un Kelvin o un Celsius).
Esta propiedad está determinada por la cantidad de formas en que los átomos y moléculas de un material pueden almacenar energía cinética. Esto incluye vibraciones, rotaciones y traslaciones.
Una sustancia con una alta capacidad calorífica puede absorber una gran cantidad de energía térmica con solo un pequeño aumento en su temperatura.
El viaje hacia la fusión: cómo interactúan
Aunque son propiedades independientes, la capacidad calorífica y el punto de fusión desempeñan papeles secuenciales en el proceso de fusión de una sustancia. El proceso ocurre en fases distintas.
Fase 1: Calentamiento del sólido
Esta es la fase en la que la capacidad calorífica es el factor dominante. A medida que se añade energía térmica a un sólido, su temperatura aumenta.
Un material con una alta capacidad calorífica se calentará más lentamente que uno con una baja capacidad calorífica, asumiendo la misma tasa de entrada de energía. "Absorbe" más energía por cada grado de aumento de temperatura.
Fase 2: La meseta de fusión
Una vez que el material alcanza su punto de fusión, ocurre algo crucial: su temperatura deja de subir, incluso si se sigue añadiendo calor.
Toda la energía que se añade se utiliza ahora exclusivamente para romper los enlaces de la estructura sólida, un proceso regido por otra propiedad llamada calor latente de fusión.
Durante este cambio de fase, la capacidad calorífica es conceptualmente irrelevante porque la temperatura es estática. La energía está causando un cambio de estado, no un cambio de temperatura.
Fase 3: Calentamiento del líquido
Después de que todo el sólido se ha transformado en líquido, la temperatura de la sustancia comenzará a subir de nuevo a medida que se añade más calor.
La fase líquida de la sustancia tiene su propia capacidad calorífica distinta, que a menudo es diferente de la capacidad calorífica de su forma sólida.
Comprendiendo la idea errónea común
La confusión entre estas dos propiedades a menudo surge porque ambas son fundamentales para el comportamiento térmico de un material. Sin embargo, confundir su correlación con la causalidad es un error crítico.
La trampa de la correlación vs. la causalidad
No existe ningún vínculo causal fiable entre la capacidad calorífica y el punto de fusión. Una alta capacidad calorífica no implica un alto punto de fusión, y viceversa.
Considere estos ejemplos:
- El agua tiene una capacidad calorífica específica muy alta (4.184 J/g°C) pero un bajo punto de fusión de 0°C.
- El tungsteno tiene una capacidad calorífica específica mucho más baja (0.134 J/g°C) pero uno de los puntos de fusión más altos de cualquier elemento, a 3.422°C.
Esto demuestra que una propiedad no puede usarse para predecir la otra. Están controladas por diferentes físicas subyacentes: la fuerza de los enlaces para el punto de fusión y los modos de almacenamiento de energía para la capacidad calorífica.
Tomando la decisión correcta para su objetivo
Al analizar las propiedades térmicas de un material, concéntrese en la propiedad que responde directamente a su pregunta.
- Si su enfoque principal es predecir la temperatura de un cambio de fase: Observe solo el punto de fusión. La capacidad calorífica es irrelevante para a qué temperatura se fundirá.
- Si su enfoque principal es calcular los requisitos totales de energía: Debe usar la capacidad calorífica para encontrar la energía necesaria para alcanzar el punto de fusión, y luego el calor latente de fusión para encontrar la energía necesaria para completar la fusión.
- Si su enfoque principal es la estabilidad térmica: Un punto de fusión alto significa que un material permanece sólido a altas temperaturas. Una capacidad calorífica alta significa que el material resiste los cambios de temperatura, lo que lo convierte en un buen amortiguador térmico.
Comprender los roles distintos de la capacidad calorífica y el punto de fusión es clave para predecir y diseñar con precisión cómo se comportan los materiales bajo estrés térmico.
Tabla resumen:
| Propiedad | Definición | Influencia clave |
|---|---|---|
| Punto de fusión | La temperatura específica a la que un sólido se convierte en líquido. | Fuerza de los enlaces intermoleculares. |
| Capacidad calorífica | La energía necesaria para elevar la temperatura de un material en 1°C. | Formas en que los átomos/moléculas almacenan energía cinética. |
| Calor latente de fusión | La energía requerida para fundir un sólido en su punto de fusión. | Energía para romper enlaces durante el cambio de fase. |
¿Necesita equipos de análisis térmico precisos para su laboratorio? Comprender las propiedades de los materiales como la capacidad calorífica y el punto de fusión es fundamental para obtener resultados precisos. KINTEK se especializa en hornos de laboratorio, calorímetros y consumibles de alta calidad diseñados para pruebas térmicas fiables. Nuestro equipo le ayuda a lograr un control preciso de la temperatura y mediciones de energía, asegurando que su investigación y control de calidad se basen en datos sólidos. Contacte a nuestros expertos hoy para encontrar la solución de análisis térmico perfecta para las necesidades de su laboratorio.
Guía Visual
Productos relacionados
- Horno de Mufla de Laboratorio con Elevación Inferior
- Horno de mufla de 1800℃ para laboratorio
- Horno de mufla de 1400 ℃ para laboratorio
- Horno de mufla de 1700℃ para laboratorio
- Horno de Tubo de Laboratorio de Alta Temperatura de 1400℃ con Tubo de Alúmina
La gente también pregunta
- ¿Qué significa 'sinterizado' y por qué es importante entenderlo? Desbloquea Materiales y Fabricación Avanzados
- ¿Cuál es la forma más común de tratamiento térmico? Dominando el recocido, el endurecimiento y el revenido
- ¿Cómo se comprueba la temperatura de un horno de mufla? Una guía para una monitorización precisa
- ¿Cuál es el principio y el procedimiento del horno mufla? Domine el procesamiento seguro y libre de contaminantes a altas temperaturas
- ¿Qué es un horno de mufla? Una guía para el calentamiento a alta temperatura y sin contaminación



















