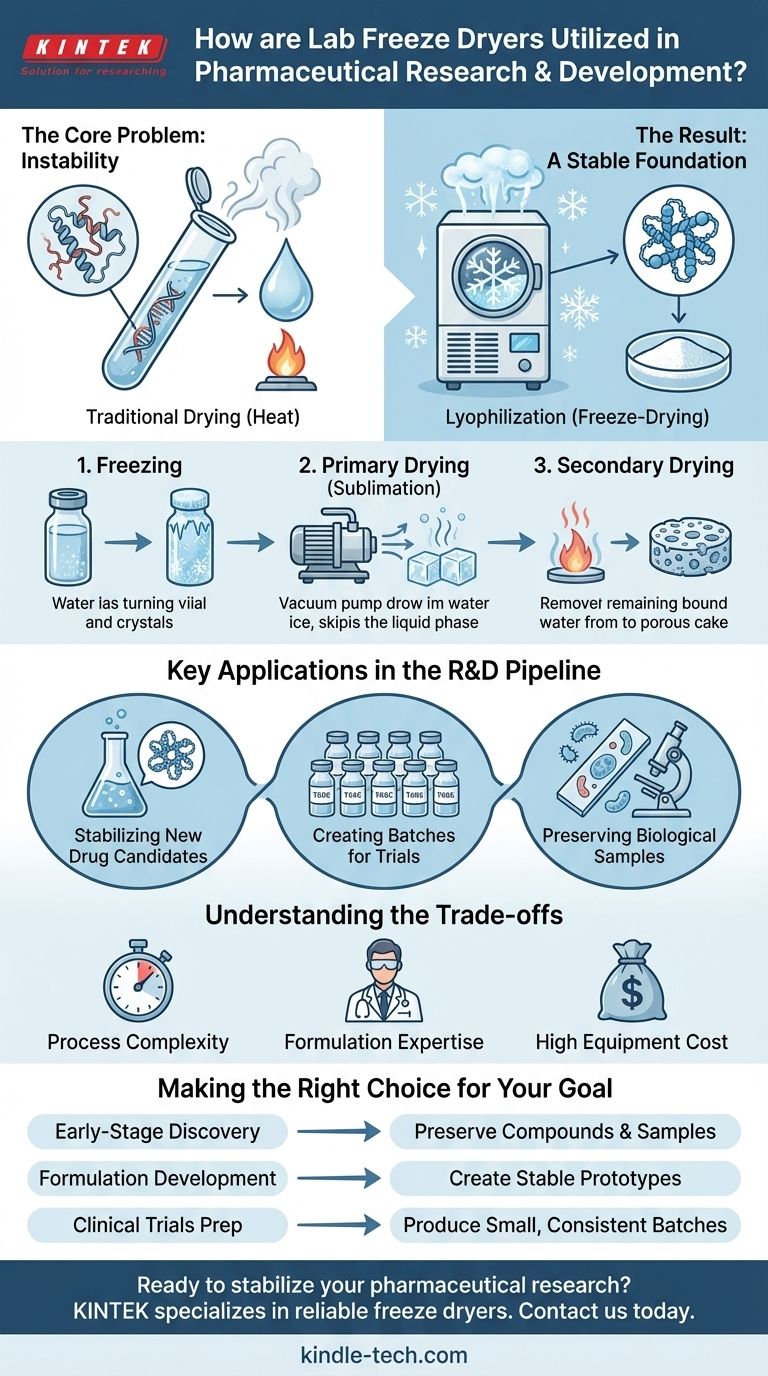
En la investigación y el desarrollo farmacéutico, los liofilizadores de laboratorio son fundamentales para estabilizar nuevos y delicados candidatos a fármacos y preservar muestras biológicas. Mediante un proceso de deshidratación a baja temperatura denominado liofilización, estas máquinas eliminan el agua de los compuestos sensibles al calor sin dañar su estructura molecular ni su actividad biológica. Esto permite a los investigadores producir lotes pequeños y estables de fármacos en investigación para pruebas preclínicas y ensayos clínicos.
El principal desafío en el desarrollo moderno de fármacos es gestionar la fragilidad inherente de moléculas complejas como proteínas, vacunas y ciertos API. La liofilización resuelve esto preservando la integridad de un compuesto, haciéndolo lo suficientemente estable para su almacenamiento, transporte y pruebas, lo que sustenta la fiabilidad de toda la cadena de I+D.

El problema central: inestabilidad de los medicamentos modernos
Por qué fallan los métodos de secado tradicionales
Muchos de los fármacos más prometedores de la actualidad, especialmente los productos biológicos como proteínas y vacunas, son extremadamente sensibles al calor.
Los métodos de secado tradicionales, que utilizan calor para evaporar el agua, harían que estas moléculas complejas se desnaturalizaran (desplegaran y perdieran su forma tridimensional específica). Este cambio estructural es irreversible y hace que el fármaco sea biológicamente inactivo y, por lo tanto, inútil.
Cómo funciona la liofilización
La liofilización, o liofilización, evita los efectos destructivos del calor eliminando el agua a bajas temperaturas y baja presión.
El proceso consta de tres etapas principales:
- Congelación: El material se congela hasta quedar sólido, atrapando las moléculas de agua en forma de hielo.
- Secado primario (Sublimación): Se reduce la presión a un vacío casi total y se añade una pequeña cantidad de energía. Esto hace que el hielo se convierta directamente en vapor de agua, omitiendo por completo la fase líquida.
- Secado secundario: Cualquier molécula de agua restante no congelada se elimina suavemente del material.
El resultado: una base estable para la investigación
El producto final es un sólido seco, poroso y ligero, a menudo denominado "pastel". Este material liofilizado es químicamente estable a temperatura ambiente y puede almacenarse durante largos períodos.
Fundamentalmente, conserva la actividad biológica original del fármaco y puede reconstituirse rápida y fácilmente con un líquido estéril antes de su uso.
Aplicaciones clave en la cadena de I+D
Estabilización de nuevos candidatos a fármacos
Durante la investigación en fase inicial, los científicos sintetizan o descubren nuevos Ingredientes Farmacéuticos Activos (API). La liofilización se utiliza para preservar estos compuestos novedosos, ya sean moléculas pequeñas o productos biológicos grandes, garantizando que sigan siendo estables para una caracterización y pruebas posteriores.
Creación de lotes para ensayos preclínicos y clínicos
Una vez identificado un candidato a fármaco prometedor, debe formularse en un producto utilizable para las pruebas. Los liofilizadores de laboratorio se utilizan para producir los lotes pequeños y consistentes necesarios para los estudios preclínicos en animales y los ensayos clínicos en humanos en fase inicial.
Esto garantiza que se esté probando exactamente la misma formulación en cada etapa, lo cual es vital para generar datos fiables y válidos.
Preservación de muestras biológicas para análisis
La I+D farmacéutica se basa en el análisis preciso de muestras biológicas como enzimas, cultivos celulares y tejidos. La liofilización preserva estos materiales en un estado casi nativo.
Esto previene la degradación y garantiza que los resultados experimentales sean precisos y reproducibles, lo cual es fundamental para tomar decisiones científicas y empresariales sólidas.
Comprensión de las compensaciones
Complejidad y tiempo del proceso
La liofilización es un proceso muy técnico, lento y que consume mucha energía. Un solo ciclo puede tardar desde varias horas hasta varios días, lo que lo hace significativamente más lento que otros métodos de secado.
La necesidad de experiencia en formulación
No todas las soluciones de fármacos pueden liofilizarse con éxito. El proceso requiere un desarrollo de formulación cuidadoso para incluir excipientes (agentes estabilizadores) que protejan el API durante las tensiones de la congelación y el secado, garantizando que el producto final sea estable y eficaz.
Alto coste del equipo
El equipo de liofilización supone una inversión de capital importante. La tecnología necesaria para mantener temperaturas y presiones muy bajas es compleja y costosa, tanto de adquirir como de operar.
Tomar la decisión correcta para su objetivo
Al comprender sus aplicaciones específicas, puede aprovechar estratégicamente la liofilización para hacer avanzar su proyecto.
- Si su objetivo principal es el descubrimiento de fármacos en fase inicial: Utilice la liofilización para preservar la estabilidad de nuevos compuestos y muestras biológicas, asegurando que su investigación fundamental sea precisa.
- Si su objetivo principal es el desarrollo de formulaciones: Aproveche la liofilización para crear y probar prototipos estables de su producto farmacéutico para estudios de vida útil y evaluación preclínica.
- Si su objetivo principal es la preparación para ensayos clínicos: Emplee liofilizadores de laboratorio para producir los lotes pequeños y consistentes de su fármaco en investigación necesarios para los estudios de Fase I.
En última instancia, dominar la liofilización transforma un descubrimiento frágil en un candidato terapéutico viable listo para un mayor desarrollo.
Tabla resumen:
| Aplicación | Propósito | Beneficio clave |
|---|---|---|
| Estabilización de nuevos candidatos a fármacos | Preservar nuevos API y productos biológicos | Mantiene la integridad molecular y la actividad biológica |
| Producción de lotes para ensayos | Crear lotes preclínicos/clínicos consistentes | Garantiza datos de pruebas fiables y reproducibles |
| Preservación de muestras biológicas | Proteger enzimas, cultivos celulares y tejidos | Permite un análisis preciso y reproducible |
¿Listo para estabilizar su investigación farmacéutica con liofilización de precisión? KINTEK se especializa en liofilizadores de laboratorio y consumibles, proporcionando el equipo fiable que necesita para preservar delicados candidatos a fármacos y muestras biológicas. Nuestra experiencia apoya toda su cadena de I+D, desde el descubrimiento temprano hasta los ensayos clínicos, garantizando que sus compuestos sigan siendo estables y eficaces. Contáctenos hoy para analizar cómo nuestras soluciones pueden mejorar la eficiencia de su laboratorio y acelerar su proceso de desarrollo de fármacos.
Guía Visual
Productos relacionados
- Liofilizador de laboratorio de sobremesa para uso en laboratorio
- Liofilizador de Vacío de Laboratorio de Sobremesa
- Esterilizador de laboratorio Autoclave de laboratorio Esterilizador de vapor a presión vertical para pantalla de cristal líquido Tipo automático
- Esterilizador de autoclave de laboratorio de alta presión rápido de escritorio 16L 24L para uso en laboratorio
- Horno de Tubo de Laboratorio de Alta Temperatura de 1400℃ con Tubo de Alúmina
La gente también pregunta
- ¿Cuál es la función principal de una liofilizadora de vacío en la síntesis de PAA-HCl? Conservar la pureza y la porosidad
- ¿Cómo contribuye la liofilización al almacenamiento a largo plazo de muestras? Logre la máxima conservación sin refrigeración
- ¿Cómo beneficia la liofilización a la industria farmacéutica? Estabilizar productos biológicos y prolongar la vida útil
- ¿Qué ventajas únicas ofrecen las liofilizadoras para el pretratamiento de biomasa de microalgas? Mejora la eficiencia de extracción en el laboratorio
- ¿Cuál es la aplicación de las liofilizadoras en la preparación de catalizadores enzimáticos?
- ¿Cuáles son las ventajas de usar liofilización para materiales de cambio de fase con cubiertas de biopolímeros? Optimizar la Estabilidad
- ¿Qué son los materiales amorfos en la liofilización? La clave para prevenir el colapso del producto
- ¿Cómo contribuyen los congeladores ULT a la estabilidad de las muestras? Garantizando una integridad inquebrantable para sus valiosas muestras



















