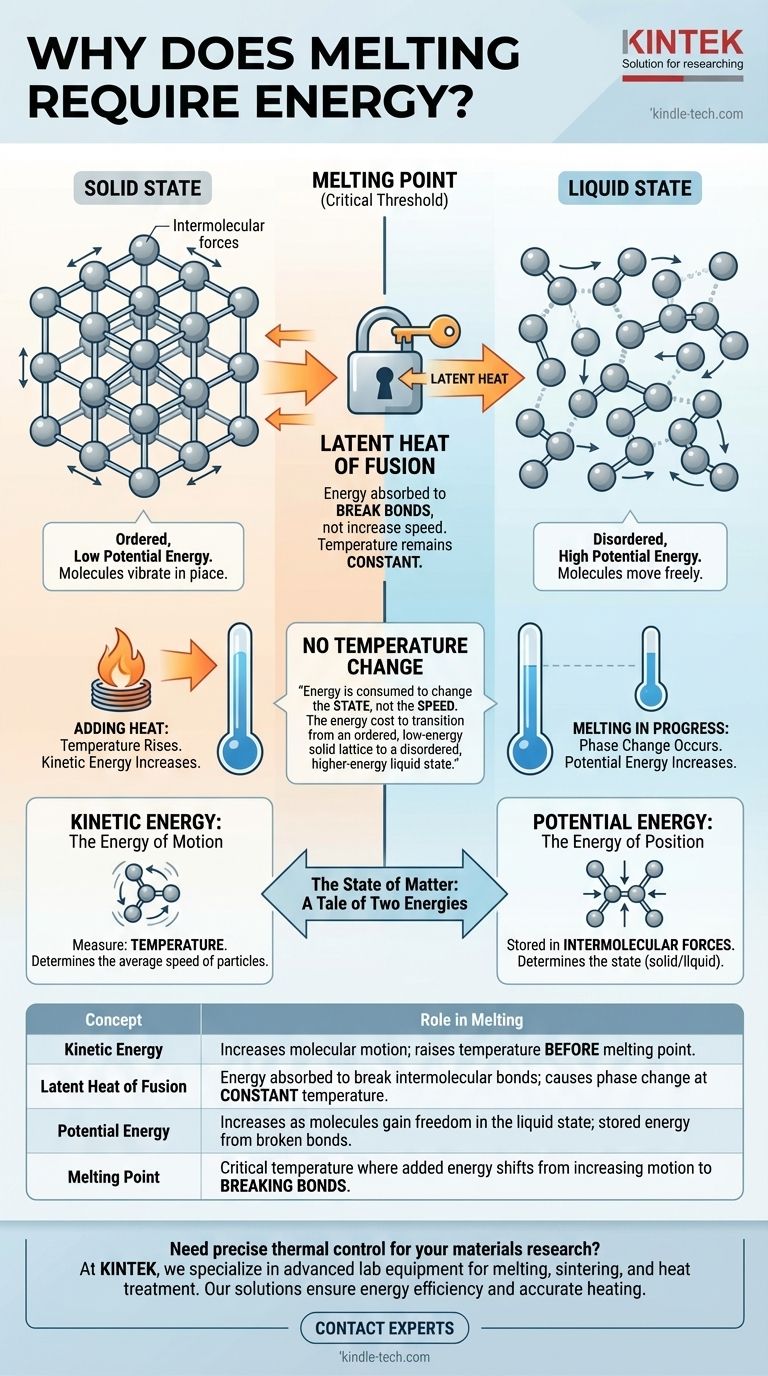
A nivel molecular, la fusión requiere energía porque esa energía se utiliza para romper los enlaces rígidos que mantienen unidas a las partículas en una estructura sólida fija. Esta energía, conocida como calor latente, no aumenta la velocidad de las moléculas —y por lo tanto no eleva la temperatura— sino que aumenta su energía potencial, dándoles la libertad de moverse y deslizarse unas sobre otras como un líquido.
La razón fundamental por la que la fusión requiere energía sin un cambio de temperatura es que la energía se consume para cambiar el estado, no la velocidad, de las moléculas. Es el coste energético para pasar de una red sólida ordenada y de baja energía a un estado líquido desordenado y de mayor energía.

El Estado de la Materia: Un Cuento de Dos Energías
Para comprender la energía de la fusión, primero debemos distinguir entre los dos tipos de energía que poseen las moléculas: cinética y potencial.
Energía Cinética: La Energía del Movimiento
La energía cinética es la energía del movimiento. En una sustancia, esto se manifiesta como la vibración, rotación y traslación de sus átomos o moléculas constituyentes.
La temperatura de una sustancia es una medida directa de la energía cinética promedio de sus partículas. Cuando se añade calor y la sustancia se calienta, es porque sus moléculas se están moviendo más rápido.
Energía Potencial: La Energía de la Posición
La energía potencial, en este contexto, es la energía almacenada en las fuerzas entre las moléculas, conocidas como fuerzas intermoleculares. Está determinada por la disposición y separación de estas partículas.
Una estructura ordenada y fuertemente unida, como un sólido, tiene baja energía potencial. Una estructura desordenada y de flujo libre, como un líquido, tiene mayor energía potencial porque las moléculas están más separadas y menos restringidas.
El Estado Sólido: Una Estructura Altamente Ordenada
En un sólido, las partículas están fijadas en un patrón repetitivo y fijo llamado red cristalina. Se mantienen en su lugar mediante fuertes fuerzas intermoleculares.
Aunque no están inmóviles, su energía cinética se limita a vibrar en su sitio. Carecen de la energía necesaria para superar las fuerzas que las mantienen en esta estructura rígida.
Desmitificando el Proceso de Fusión
El cambio de fase de sólido a líquido ocurre en un proceso distinto y por etapas donde la energía se asigna a una tarea muy específica.
Adición de Calor: La Primera Etapa
Cuando se empieza a añadir calor a un sólido (como hielo por debajo de su punto de fusión), la energía se absorbe como energía cinética. Las partículas vibran con más y más intensidad dentro de la red.
Durante esta etapa, la temperatura del sólido aumenta constantemente.
Alcanzar el Punto de Fusión: Un Umbral Crítico
El punto de fusión es la temperatura a la que las partículas vibran tan vigorosamente que están a punto de liberarse de la red.
A esta temperatura exacta, se produce un cambio fundamental. Cualquier energía adicional añadida ya no aumenta la velocidad de vibración (energía cinética). En cambio, se dirige enteramente a superar las fuerzas intermoleculares.
El Papel del Calor Latente de Fusión
La energía requerida para cambiar una sustancia de sólido a líquido a su punto de fusión se denomina calor latente de fusión. La palabra "latente" significa oculto, porque esta aportación de energía no da como resultado un cambio de temperatura.
Piense en ello como usar una llave para abrir una jaula. La energía no está haciendo que el habitante corra más rápido dentro de la jaula; se está utilizando exclusivamente para abrir la cerradura y permitirle salir.
Del Orden al Desorden: El Estado Líquido
A medida que las moléculas absorben suficiente calor latente, se liberan de sus posiciones fijas en la red. La estructura rígida colapsa y la sustancia se convierte en un líquido.
En este nuevo estado líquido, las partículas tienen una energía potencial mucho mayor, pero su energía cinética promedio (temperatura) es la misma que la del sólido del que acaban de fundirse. Solo después de que todo el sólido se haya fundido, la adición de calor posterior comenzará a aumentar la energía cinética y, por lo tanto, la temperatura del líquido.
Comprender la Distinción Clave: Calor vs. Temperatura
El concepto de calor latente resuelve un punto común de confusión. Pone de relieve la diferencia entre añadir energía y observar un aumento de la temperatura.
El Concepto Erróneo Común
Muchos se preguntan: "¿Si sigo añadiendo calor al hielo que se está derritiendo, por qué la temperatura se mantiene en 0 °C (32 °F)?"
La respuesta es que la energía tiene un trabajo diferente que hacer durante un cambio de fase. Su prioridad es romper enlaces, no aumentar la velocidad.
El Calor es Transferencia de Energía, la Temperatura es una Medida
El calor es la transferencia de energía térmica. La temperatura es una medida de la energía cinética promedio.
Durante la fusión, se está transfiriendo continuamente calor al sistema, pero esa energía se está convirtiendo en energía potencial, dejando inalterada la energía cinética promedio y, por lo tanto, la temperatura.
Cómo Aplicar Este Principio
Comprender este concepto es fundamental para muchas aplicaciones del mundo real y campos científicos.
- Si su enfoque principal es la observación cotidiana (como un cubito de hielo en una bebida): La energía que se absorbe del líquido más caliente se utiliza como calor latente para romper los enlaces moleculares del hielo, razón por la cual la bebida se enfría mientras el hielo se derrite a una temperatura constante.
- Si su enfoque principal es la ingeniería o la ciencia de los materiales: El calor latente de fusión específico es una propiedad crítica que determina el coste energético de fundir metales u otros materiales, lo que influye directamente en el diseño de hornos, el consumo de energía y la eficiencia del proceso.
- Si su enfoque principal es la química o la física: Recuerde que los cambios de fase representan un cambio en la energía potencial (debido a cambios en las fuerzas intermoleculares), mientras que los cambios de temperatura representan un cambio en la energía cinética (debido a cambios en el movimiento molecular).
Comprender el papel del calor latente es la clave para entender cómo la energía impulsa los cambios en el estado físico de toda la materia.
Tabla Resumen:
| Concepto | Función en la Fusión |
|---|---|
| Energía Cinética | Aumenta el movimiento molecular; eleva la temperatura antes del punto de fusión. |
| Calor Latente de Fusión | Energía absorbida para romper los enlaces intermoleculares; provoca el cambio de fase a temperatura constante. |
| Energía Potencial | Aumenta a medida que las moléculas ganan libertad en el estado líquido; energía almacenada por los enlaces rotos. |
| Punto de Fusión | Temperatura crítica donde la energía añadida pasa de aumentar el movimiento a romper enlaces. |
¿Necesita un control térmico preciso para su investigación de materiales? En KINTEK, nos especializamos en equipos de laboratorio avanzados que proporcionan una gestión precisa de la calefacción y la temperatura para procesos como la fusión, la sinterización y el tratamiento térmico. Tanto si trabaja con metales, cerámicas u otros materiales, nuestras soluciones garantizan la eficiencia energética y resultados reproducibles. Póngase en contacto con nuestros expertos hoy mismo para encontrar el horno o sistema de calefacción perfecto para las necesidades de su laboratorio.
Guía Visual
Productos relacionados
- Horno de Mufla de Laboratorio con Elevación Inferior
- Horno de mufla de 1800℃ para laboratorio
- Horno de mufla de 1400 ℃ para laboratorio
- Horno de mufla de 1700℃ para laboratorio
- Horno de Tubo de Laboratorio de Alta Temperatura de 1400℃ con Tubo de Alúmina
La gente también pregunta
- ¿Cuáles son los factores que afectan la velocidad del proceso de fusión? Domine la transferencia de calor para obtener resultados más rápidos
- ¿Qué es la mufla en un horno de mufla? La clave para un procesamiento a alta temperatura libre de contaminación
- ¿Cuáles son las normas de seguridad para todos los procesos de calentamiento en el laboratorio? Una guía para prevenir accidentes
- ¿Qué es un horno de mufla y cómo funciona? Logre un calentamiento limpio y de alta temperatura para su laboratorio
- ¿Cuál es el uso de un horno de mufla en la industria farmacéutica? Asegure la pureza de los medicamentos con un análisis preciso a alta temperatura



















