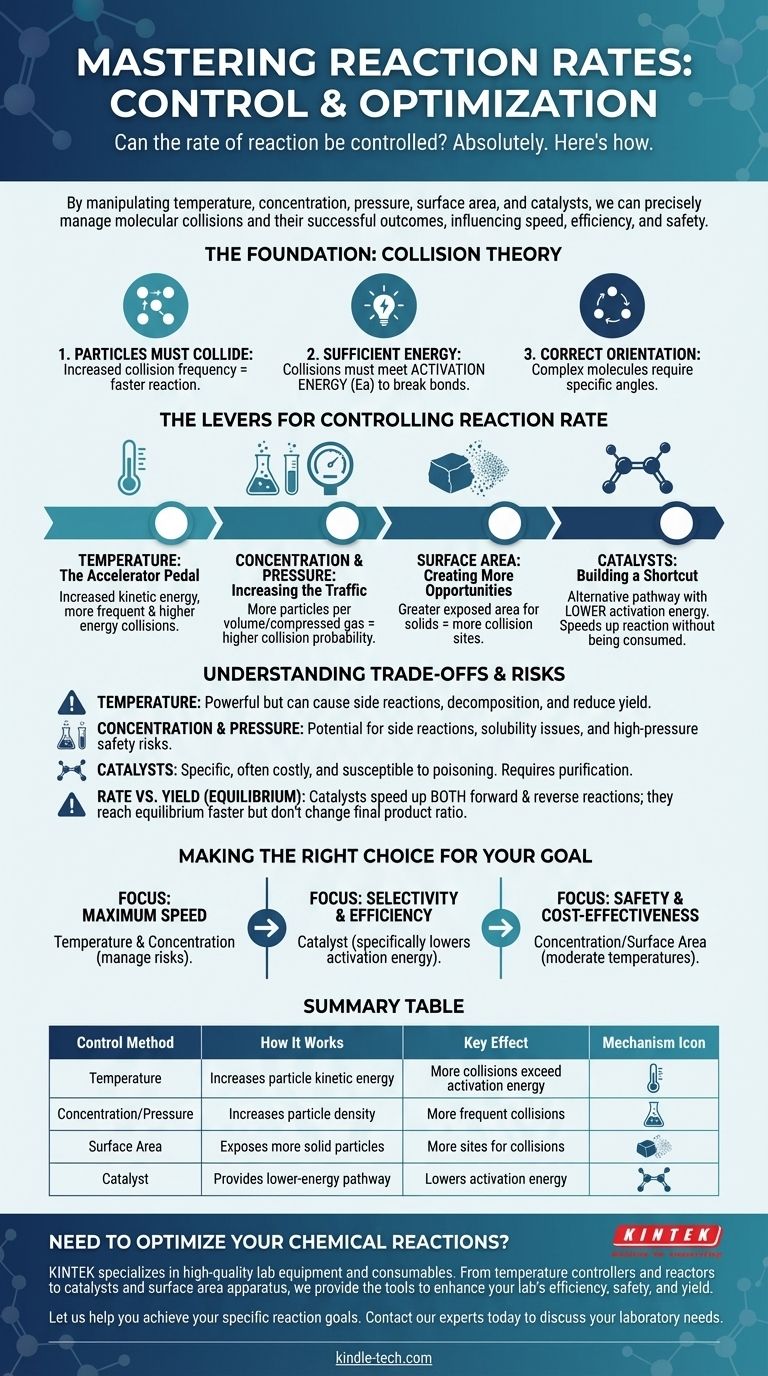
Absolutamente. La velocidad de una reacción química no es una propiedad fija; se puede controlar con precisión. Manipulando factores físicos y químicos específicos, podemos acelerar, ralentizar o incluso detener deliberadamente una reacción. Las principales palancas para este control son la temperatura, la concentración de los reactivos, la presión (para gases), el área de superficie (para sólidos) y la introducción de catalizadores.
Controlar la velocidad de una reacción se trata fundamentalmente de gestionar la frecuencia y la energía de las colisiones moleculares. Cada método, desde calentar una sustancia hasta añadir un catalizador, funciona influyendo en la frecuencia con la que chocan las partículas y si esas colisiones son exitosas.

La Base: Teoría de Colisiones
Para controlar una reacción, primero debe comprender qué la hace ocurrir. La velocidad de cualquier reacción se rige por los principios de la teoría de colisiones, que establece que deben cumplirse tres condiciones para que ocurra una reacción.
1. Las Partículas Deben Chocar
Para que dos o más moléculas reaccionen, primero deben entrar en contacto físico. Cuanto más frecuentemente chocan las partículas, más oportunidades tienen de reaccionar, lo que aumenta la velocidad de reacción.
2. Las Colisiones Deben Tener Suficiente Energía
Simplemente chocar no es suficiente. Las partículas que chocan deben poseer una cantidad mínima de energía cinética combinada, conocida como energía de activación (Ea). Esta energía es necesaria para romper los enlaces químicos existentes y que se puedan formar nuevos.
Las colisiones con menos energía que la de activación no tendrán éxito; las partículas simplemente rebotarán entre sí sin cambios.
3. Las Partículas Deben Tener la Orientación Correcta
Para moléculas complejas, la colisión también debe ocurrir en un ángulo u orientación específicos. Si las partes reactivas de las moléculas no se alinean correctamente durante la colisión, no ocurrirá ninguna reacción, incluso si se cumple el requisito de energía.
Las Palancas para Controlar la Velocidad de Reacción
Comprender la teoría de colisiones nos da una hoja de ruta clara para manipular la velocidad de reacción. Cada método de control funciona alterando una o más de las condiciones requeridas para una colisión exitosa.
Temperatura: El Pedal del Acelerador
Aumentar la temperatura eleva la energía cinética promedio de las partículas. Esto tiene un efecto poderoso y doble.
Primero, hace que las partículas se muevan más rápido, lo que lleva a colisiones más frecuentes. Segundo, y más importante, significa que una fracción mucho mayor de esas colisiones tendrá una energía igual o mayor que la energía de activación, aumentando drásticamente la velocidad de las reacciones exitosas.
Concentración y Presión: Aumentando el Tráfico
Aumentar la concentración de reactivos en una solución significa que hay más partículas empaquetadas en el mismo volumen. Esto aumenta directamente la probabilidad de colisión, elevando así la velocidad de reacción.
Para los gases, aumentar la presión tiene el mismo efecto. Fuerza a las moléculas de gas a acercarse, aumentando efectivamente su concentración y provocando colisiones más frecuentes.
Área de Superficie: Creando Más Oportunidades
Este factor es crítico cuando un sólido reacciona con un líquido o un gas. Al romper un sólido en pedazos más pequeños (por ejemplo, de un trozo sólido a un polvo), se aumenta drásticamente su área de superficie total.
Esto expone más partículas del sólido al otro reactivo, creando muchos más sitios donde pueden ocurrir colisiones y aumentando la velocidad de reacción general.
Catalizadores: Construyendo un Atajo
Un catalizador es una sustancia que aumenta la velocidad de reacción sin consumirse en el proceso. Funciona proporcionando una vía de reacción alternativa con una menor energía de activación.
Un catalizador no hace que las partículas choquen con más frecuencia o con más energía. En cambio, reduce la "barrera" de energía que una colisión debe superar para tener éxito, lo que facilita mucho el progreso de una reacción.
Comprendiendo las Ventajas y Desventajas y los Riesgos
Si bien estas palancas son efectivas, no están exentas de consecuencias. Elegir el método correcto requiere comprender sus limitaciones y posibles inconvenientes.
La Fuerza Bruta de la Temperatura
El calor es una herramienta poderosa pero indiscriminada. Si bien acelerará la reacción deseada, también acelerará cualquier posible reacción secundaria. A temperaturas muy altas, incluso puede hacer que los reactivos o productos se descompongan, disminuyendo el rendimiento general.
Los Peligros de la Concentración y la Presión
Las altas concentraciones a veces pueden provocar reacciones secundarias no deseadas o problemas de solubilidad. Más críticamente, operar a presiones muy altas requiere equipos especializados, costosos y robustos para gestionar los importantes riesgos de seguridad de una posible falla de contención.
La Especificidad y el Costo de los Catalizadores
Los catalizadores suelen ser muy específicos y pueden ser muy caros (por ejemplo, los que utilizan platino o paladio). También pueden quedar inutilizados por impurezas, un proceso conocido como envenenamiento del catalizador, lo que requiere una cuidadosa purificación de los reactivos.
Velocidad vs. Rendimiento (Equilibrio)
Es crucial distinguir entre la velocidad de reacción y el rendimiento de la reacción. Para las reacciones reversibles, que pueden proceder en ambas direcciones (directa e inversa), un catalizador acelera ambas reacciones por igual. Esto significa que se alcanzará el equilibrio más rápido, pero no cambiará la proporción final de productos a reactivos.
Tomando la Decisión Correcta para Su Objetivo
La estrategia óptima para controlar una reacción depende completamente de su objetivo específico, ya sea velocidad, eficiencia o seguridad.
- Si su enfoque principal es la máxima velocidad: Aumentar la temperatura y la concentración son sus herramientas más directas, pero debe gestionar activamente los riesgos de reacciones secundarias y peligros de seguridad.
- Si su enfoque principal es la selectividad y la eficiencia: Un catalizador suele ser la mejor opción, ya que puede reducir específicamente la energía de activación para la reacción deseada sin promover otras.
- Si su enfoque principal es la seguridad y la rentabilidad: Manipular la concentración o el área de superficie a temperaturas moderadas suelen ser los métodos más accesibles y de menor riesgo.
Dominar estos factores le permite transformar las reacciones químicas de eventos fijos en procesos dinámicos que pueden dirigirse con precisión para lograr un resultado específico.
Tabla Resumen:
| Método de Control | Cómo Funciona | Efecto Clave |
|---|---|---|
| Temperatura | Aumenta la energía cinética de las partículas | Más colisiones superan la energía de activación |
| Concentración/Presión | Aumenta la densidad de partículas | Colisiones más frecuentes |
| Área de Superficie | Expone más partículas de reactivo sólido | Más sitios para colisiones |
| Catalizador | Proporciona una vía de reacción de menor energía | Reduce la energía de activación |
¿Necesita optimizar sus reacciones químicas?
El control preciso de las velocidades de reacción es clave para el éxito del trabajo de laboratorio. Ya sea que necesite acelerar una síntesis, mejorar la selectividad o garantizar una operación segura, el equipo adecuado es esencial.
KINTEK se especializa en proporcionar equipos y consumibles de laboratorio de alta calidad para ayudarle a dominar estas variables. Desde controladores de temperatura y reactores de precisión para gestionar el calor y la presión hasta una amplia gama de catalizadores y aparatos diseñados para una interacción óptima del área de superficie, tenemos las herramientas para mejorar la eficiencia, seguridad y rendimiento de su laboratorio.
Permítanos ayudarle a alcanzar sus objetivos de reacción específicos. Contacte a nuestros expertos hoy para discutir sus necesidades de laboratorio y encontrar la solución perfecta.
Guía Visual
Productos relacionados
- Reactores personalizables de alta presión para aplicaciones científicas e industriales avanzadas
- Reactores de Laboratorio Personalizables de Alta Temperatura y Alta Presión para Diversas Aplicaciones Científicas
- Mini Reactor Autoclave de Alta Presión SS para Uso en Laboratorio
- Reactor Autoclave de Laboratorio de Alta Presión para Síntesis Hidrotermal
- Prensa Isostática en Caliente WIP Estación de Trabajo 300Mpa para Aplicaciones de Alta Presión
La gente también pregunta
- ¿Cuál es el propósito de usar un reactor hidrotermal de alta temperatura? Mejora la síntesis de cátodos de yodo en carbón activado
- ¿Cómo demuestra su valor un reactor de alta presión en el envejecimiento acelerado? Predicción rápida de la durabilidad del catalizador
- ¿Cuál es el propósito de usar gas argón de alta pureza en un reactor de alta presión? Asegurar datos precisos de pruebas de corrosión
- ¿Qué funciones desempeñan las autoclaves en la síntesis de zeolitas MFI? Domina el crecimiento cristalino hidrotermal
- ¿Qué papel juega un autoclave en la simulación de las condiciones de un REAP? Validación avanzada de materiales para la seguridad nuclear



















