En la espectroscopia infrarroja (IR), la concentración gobierna directamente la intensidad de las bandas de absorción. Una mayor concentración de un analito en una muestra da como resultado una mayor absorción de la radiación IR en sus frecuencias características. Esto hace que los picos correspondientes en el espectro IR se vuelvan más altos y prominentes, una relación descrita matemáticamente por la Ley de Beer-Lambert.
La relación entre la concentración y la absorbancia IR es poderosa para el análisis cuantitativo, pero no es perfectamente lineal en todas las situaciones. Comprender sus limitaciones prácticas, como la saturación del detector a altas concentraciones y los efectos intermoleculares, es crucial para una interpretación y medición espectral precisas.
El Principio Fundamental: La Ley de Beer-Lambert
La conexión entre la concentración y la absorbancia es la piedra angular de la espectroscopia cuantitativa. Proporciona un modelo predecible de cómo la luz interactúa con la materia.
Definición de la Ecuación (A = εbc)
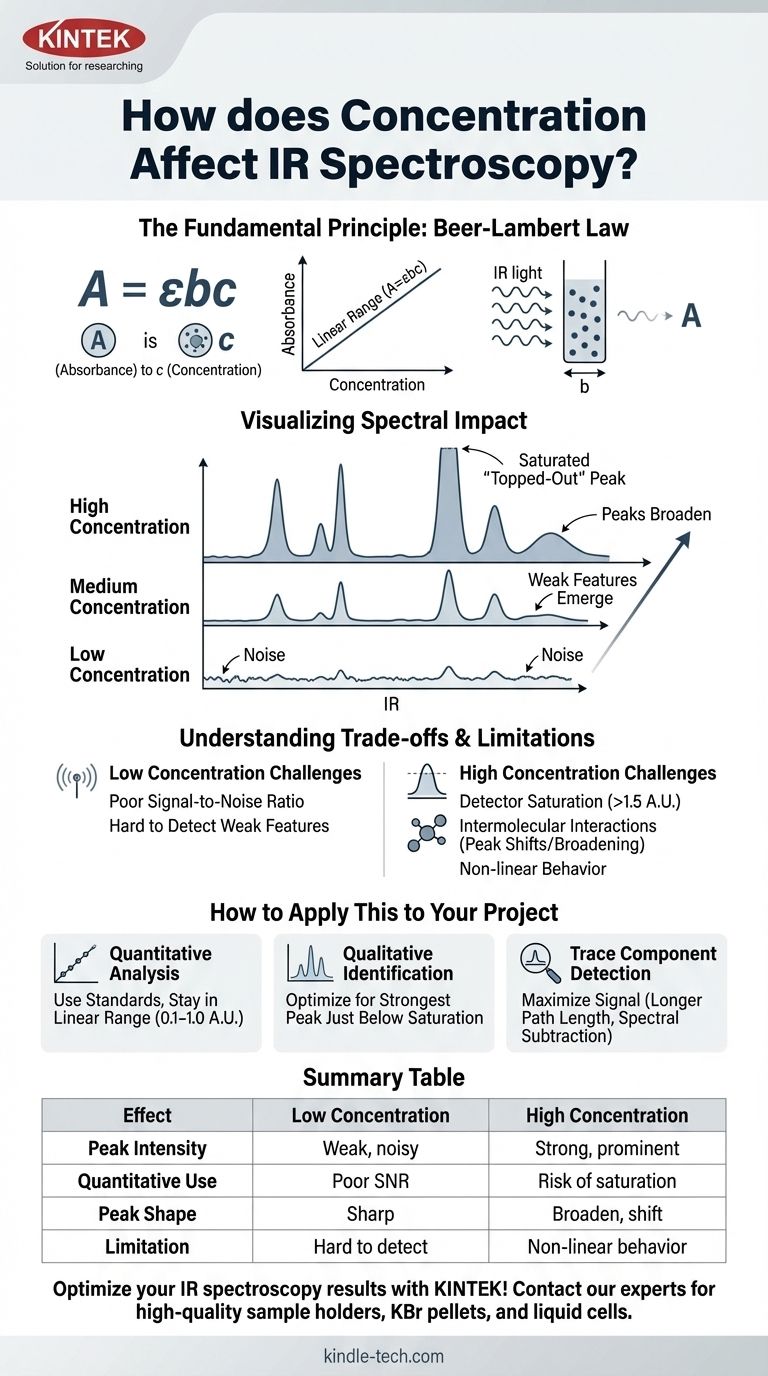
La Ley de Beer-Lambert se expresa como A = εbc.
- A es la Absorbancia (adimensional).
- ε (épsilon) es la absorptividad molar, una propiedad intrínseca de la molécula a una longitud de onda específica.
- b es la longitud de paso del portamuestras (por ejemplo, el grosor de una celda líquida), generalmente en cm.
- c es la concentración del analito.
Esta ecuación muestra que la absorbancia es directamente proporcional a la concentración cuando la longitud de paso y la absortividad molar son constantes.
Absorbancia frente a Transmitancia
Los instrumentos IR miden físicamente la Transmitancia (%T), que es la fracción de luz que atraviesa la muestra. Sin embargo, los analistas casi siempre trabajan con la Absorbancia (A).
Ambas están relacionadas por la fórmula A = -log(T). Trazar la absorbancia frente a la concentración produce una línea recta, que es mucho más útil para el análisis que la curva exponencial producida por la transmitancia.
Visualización del Impacto Espectral
A medida que aumenta la concentración de una sustancia:
- Los picos crecen: Los valores de absorbancia de todos los picos aumentan.
- Aparecen características débiles: Los picos pequeños que se perdían en el ruido de la línea base a bajas concentraciones se vuelven visibles.
- Los picos fuertes se ensanchan: Las bandas de absorción muy intensas no solo se harán más altas, sino también más anchas.
Comprensión de las Compensaciones y Limitaciones
La Ley de Beer-Lambert describe un escenario ideal. En la práctica, varios factores pueden causar desviaciones de esta relación lineal, especialmente a altas concentraciones.
El Problema de los Picos "Saturados"
Cuando la concentración es demasiado alta, un pico puede volverse tan intenso que absorbe casi toda la luz a esa frecuencia. La absorbancia puede exceder el rango óptimo del detector (típicamente > 1.5 U.A.).
Esto hace que el pico aparezca aplanado o "recortado en la parte superior". Se pierde toda la información cuantitativa en ese pico saturado, ya que el instrumento ya no puede medir con precisión la absorbancia real.
Interacciones Intermoleculares
A altas concentraciones, las moléculas están más juntas y pueden interactuar entre sí. Un ejemplo clásico es el enlace de hidrógeno en alcoholes o ácidos carboxílicos.
Estas interacciones pueden alterar la energía vibratoria de los enlaces, haciendo que los picos cambien de posición, cambien de forma o se ensanchen. Esto cambia la absortividad molar (ε), rompiendo la simple relación lineal entre absorbancia y concentración.
Efectos Instrumentales
Ningún instrumento es perfecto. Una pequeña cantidad de luz parásita puede llegar al detector sin pasar por la muestra. Esto hace que las lecturas de absorbancia se estabilicen a altas concentraciones, lo que da como resultado una curva que se dobla hacia el eje x en lugar de permanecer lineal.
El Desafío de las Bajas Concentraciones
A la inversa, si una muestra está demasiado diluida, la absorbancia puede ser demasiado baja para distinguirla del ruido de la línea base instrumental. La mala relación señal/ruido hace que tanto la identificación cualitativa como la medición cuantitativa no sean fiables.
Cómo Aplicar Esto a Su Proyecto
Su enfoque de la concentración de la muestra depende completamente de su objetivo analítico. Debe preparar su muestra de una manera que optimice el espectro para su propósito específico.
- Si su enfoque principal es el análisis cuantitativo: Prepare una serie de estándares y cree una curva de calibración, asegurándose de que la absorbancia de su muestra desconocida se encuentre dentro del rango lineal de su curva (típicamente 0.1–1.0 U.A.).
- Si su enfoque principal es la identificación cualitativa: Ajuste la preparación de su muestra (por ejemplo, cantidad en un pellet de KBr, longitud de paso de una celda líquida) para obtener un espectro donde el pico más fuerte esté justo por debajo de la saturación, asegurando que las bandas de grupos funcionales más débiles sean claramente visibles.
- Si su enfoque principal es la detección de un componente traza: Utilice técnicas que maximicen la señal del analito, como emplear celdas de mayor longitud de paso o realizar sustracción espectral para eliminar la interferencia de un solvente o matriz.
En última instancia, controlar y comprender la concentración es la clave para transformar un espectro IR de una simple huella dactilar a una herramienta analítica precisa.
Tabla Resumen:
| Efecto de la Concentración | Baja Concentración | Alta Concentración |
|---|---|---|
| Intensidad del Pico | Picos débiles y ruidosos | Picos fuertes y prominentes |
| Uso Cuantitativo | Mala relación señal/ruido | Riesgo de saturación del detector |
| Forma del Pico | Nítidos y bien definidos | Pueden ensancharse y desplazarse |
| Limitación Clave | Difícil de detectar | Comportamiento no lineal de Beer-Lambert |
¡Optimice sus resultados de espectroscopia IR con KINTEK!
Ya sea que esté realizando un análisis cuantitativo preciso o necesite una identificación cualitativa fiable, la preparación adecuada de la muestra es clave. KINTEK se especializa en equipos y consumibles de laboratorio de alta calidad, incluidos portamuestras IR, pastillas de KBr y celdas líquidas diseñadas para ayudarle a lograr la concentración y la longitud de paso óptimas para espectros claros y precisos.
Contacte a nuestros expertos hoy mismo para discutir sus necesidades específicas de laboratorio y descubrir cómo nuestras soluciones pueden mejorar su flujo de trabajo de espectroscopia y la fiabilidad de sus datos.
Guía Visual
Productos relacionados
- Dióxido de iridio IrO2 para electrólisis del agua
- Lente de silicio monocristalino de alta resistencia infrarroja
- Horno de Grafización Experimental de Vacío de Grafito IGBT
- Sustrato de zafiro con recubrimiento de transmisión infrarroja
- Sustrato de Vidrio de Ventana Óptica Placas de Sulfuro de Zinc ZnS
La gente también pregunta
- ¿Cuáles son las impurezas en el aceite de pirólisis? Desvelando la compleja química del bio-crudo
- ¿Cuál es el efecto del contenido de humedad en la pirólisis de biomasa? Optimice la eficiencia de su conversión de biomasa
- ¿Cuáles son los beneficios de la pulverización catódica por RF? Deposición de películas delgadas versátil y estable
- ¿Qué problemas técnicos resuelve un horno de secado al vacío en experimentos con mortero AAS? Garantizar la pureza y la precisión
- ¿Cuál es el mecanismo de la pulverización catódica reactiva? Una guía para la deposición de películas delgadas
- ¿Cuáles son las aplicaciones de las películas delgadas en los semiconductores? Impulsando la electrónica moderna desde los transistores hasta las células solares
- ¿Cómo contribuye un dispositivo de agitación mecánica a la uniformidad de los recubrimientos de óxido dopado? Mejora la calidad del catalizador PEO
- ¿Cuál es la fuente de energía para la pirólisis? Del calor externo a los sistemas autosostenibles
















