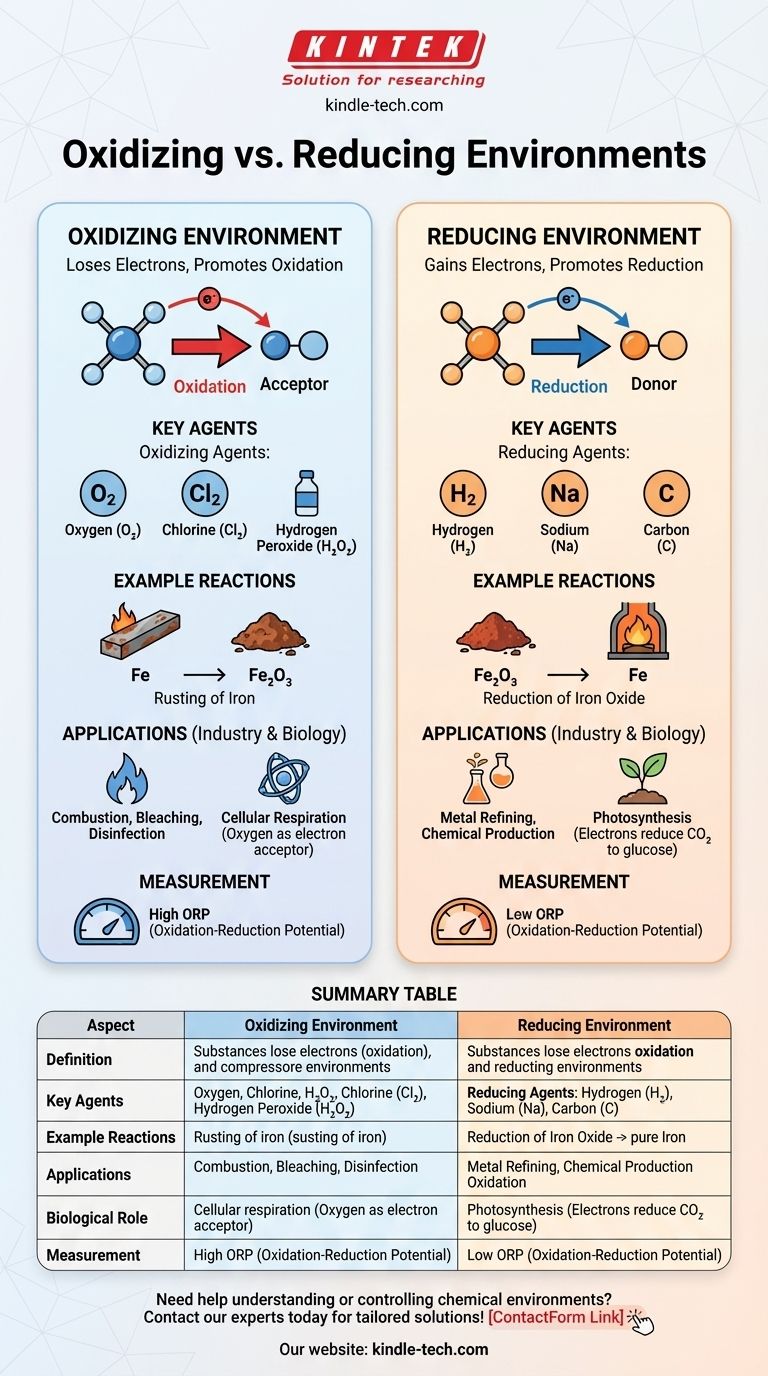
En química, un ambiente oxidante es aquel donde las sustancias tienden a perder electrones, promoviendo reacciones de oxidación, mientras que un ambiente reductor es aquel donde las sustancias tienden a ganar electrones, promoviendo reacciones de reducción. La diferencia clave radica en la disponibilidad de aceptores de electrones (agentes oxidantes) o donadores de electrones (agentes reductores). Los ambientes oxidantes se caracterizan por la presencia de agentes oxidantes como el oxígeno o los halógenos, que facilitan la pérdida de electrones. En contraste, los ambientes reductores contienen agentes reductores como el hidrógeno o los metales, que facilitan la ganancia de electrones. Estos ambientes desempeñan roles críticos en las reacciones químicas, los procesos industriales y los sistemas biológicos.

Puntos clave explicados:
-
Definición de ambientes oxidantes y reductores:
- Ambiente oxidante: Un ambiente químico donde las sustancias tienen más probabilidades de perder electrones, lo que lleva a la oxidación. Este ambiente es rico en agentes oxidantes, como oxígeno, cloro u otros aceptores de electrones.
- Ambiente reductor: Un ambiente químico donde las sustancias tienen más probabilidades de ganar electrones, lo que lleva a la reducción. Este ambiente es rico en agentes reductores, como hidrógeno, metales u otros donadores de electrones.
-
Función de los agentes oxidantes y reductores:
- Agentes oxidantes: Son sustancias que aceptan electrones de otras sustancias, oxidándolas. Ejemplos comunes incluyen oxígeno (O₂), cloro (Cl₂) y peróxido de hidrógeno (H₂O₂).
- Agentes reductores: Son sustancias que donan electrones a otras sustancias, reduciéndolas. Ejemplos comunes incluyen hidrógeno (H₂), sodio (Na) y carbono (C).
-
Reacciones químicas en diferentes ambientes:
- Ambiente oxidante: En un ambiente así, dominan las reacciones de oxidación. Por ejemplo, la oxidación del hierro ocurre en un ambiente oxidante donde el hierro (Fe) pierde electrones al oxígeno, formando óxido de hierro (Fe₂O₃).
- Ambiente reductor: En un ambiente así, dominan las reacciones de reducción. Por ejemplo, la reducción de óxidos metálicos a metales puros ocurre en un ambiente reductor, como cuando se usa carbono para reducir el óxido de hierro a hierro en un alto horno.
-
Aplicaciones en la industria y la biología:
- Aplicaciones industriales: Los ambientes oxidantes se utilizan en procesos como la combustión, el blanqueo y la desinfección. Los ambientes reductores son cruciales en procesos como la refinación de metales y la producción de ciertos productos químicos.
- Sistemas biológicos: En los sistemas biológicos, los ambientes oxidantes se encuentran en procesos como la respiración celular, donde el oxígeno actúa como aceptor final de electrones. Los ambientes reductores se encuentran en procesos como la fotosíntesis, donde se donan electrones para reducir el dióxido de carbono a glucosa.
-
Medición y control:
- Potencial de oxidación-reducción (ORP): El ORP es una medida de la tendencia de un ambiente químico a ganar o perder electrones. Un ORP alto indica un ambiente oxidante, mientras que un ORP bajo indica un ambiente reductor.
- Control en procesos industriales: En las industrias, controlar la naturaleza oxidante o reductora del ambiente es crucial para optimizar las reacciones químicas, asegurar la calidad del producto y prevenir reacciones secundarias no deseadas.
-
Ejemplos de ambientes oxidantes y reductores:
- Ambiente oxidante: La atmósfera terrestre es un ambiente oxidante debido a la presencia de oxígeno. Por eso, metales como el hierro se corroen cuando se exponen al aire.
- Ambiente reductor: El interior de un alto horno es un ambiente reductor donde el monóxido de carbono (CO) actúa como agente reductor para convertir el mineral de hierro (Fe₂O₃) en hierro metálico (Fe).
Al comprender las diferencias entre ambientes oxidantes y reductores, los químicos e ingenieros pueden controlar y optimizar mejor las reacciones químicas en diversas aplicaciones, desde procesos industriales hasta sistemas biológicos.
Tabla resumen:
| Aspecto | Ambiente oxidante | Ambiente reductor |
|---|---|---|
| Definición | Las sustancias pierden electrones (oxidación) debido a aceptores de electrones como oxígeno o halógenos. | Las sustancias ganan electrones (reducción) debido a donadores de electrones como hidrógeno o metales. |
| Agentes clave | Agentes oxidantes: Oxígeno (O₂), cloro (Cl₂), peróxido de hidrógeno (H₂O₂). | Agentes reductores: Hidrógeno (H₂), sodio (Na), carbono (C). |
| Ejemplo de reacciones | Oxidación del hierro (Fe → Fe₂O₃). | Reducción del óxido de hierro a hierro (Fe₂O₃ → Fe). |
| Aplicaciones | Combustión, blanqueo, desinfección. | Refinación de metales, producción química. |
| Rol biológico | Respiración celular (oxígeno como aceptor de electrones). | Fotosíntesis (los electrones reducen el CO₂ a glucosa). |
| Medición | Alto potencial de oxidación-reducción (ORP). | Bajo potencial de oxidación-reducción (ORP). |
¿Necesita ayuda para comprender o controlar los ambientes químicos? Contacte a nuestros expertos hoy para soluciones personalizadas.
Guía Visual
Productos relacionados
- Horno de Atmósfera de Hidrógeno y Nitrógeno Controlado
- Equipo de sistema de máquina HFCVD para recubrimiento de nanodiamante de matriz de trefilado
- Equipo de sistema de horno de tubo CVD versátil hecho a medida para deposición química de vapor
- Horno de Fusión por Inducción al Vacío a Escala de Laboratorio
- Horno de grafito al vacío para material negativo Horno de grafiación
La gente también pregunta
- ¿Cuáles son los principales beneficios de usar sinterización con fuego de hidrógeno para piezas? Lograr densidad máxima y resistencia a la corrosión
- ¿Para qué se utilizan los hornos de hidrógeno? Logre pureza y velocidad en el procesamiento a alta temperatura
- ¿Por qué se debe mantener una atmósfera reductora de hidrógeno para el recocido de tungsteno? Garantice la pureza en el procesamiento a alta temperatura
- ¿Por qué es necesario un horno industrial con control de atmósfera de hidrógeno para la pre-sinterización de materiales de Fe-Cr-Al?
- ¿Qué es el tratamiento térmico en atmósfera de hidrógeno? Logre una pureza y un brillo superficial superiores












