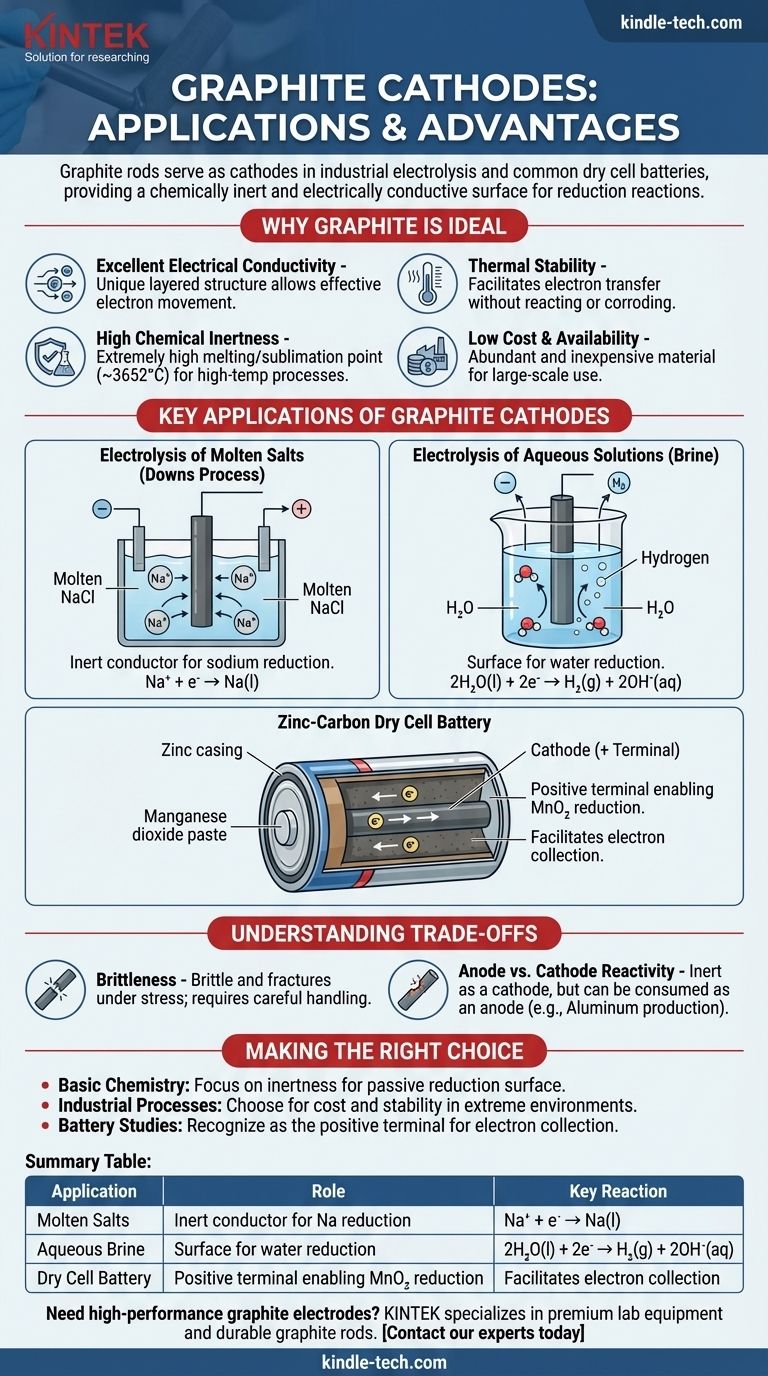
Las varillas de grafito sirven como cátodos en varios procesos electroquímicos clave, especialmente en la electrólisis industrial de sales y dentro de las pilas secas comunes. En estas aplicaciones, la función principal de la varilla de grafito no es consumirse o reaccionar, sino actuar como una superficie químicamente inerte y eléctricamente conductora donde puede tener lugar una reacción de reducción.
El grafito se elige como material de cátodo no porque participe en la reacción primaria, sino porque es un excelente conductor inerte. Su combinación única de conductividad eléctrica, resistencia química, alta estabilidad térmica y bajo costo lo convierte en una plataforma ideal para que ocurra la semirreacción de reducción.

Por qué el grafito es un material de cátodo ideal
La selección de un material para un electrodo es una elección de diseño crítica en cualquier celda electroquímica. El grafito (una forma específica de carbono) posee un conjunto de propiedades que lo hacen excepcionalmente adecuado para el papel de cátodo.
Excelente conductividad eléctrica
El grafito tiene una estructura laminar y plana única. Dentro de estas capas, los electrones deslocalizados son libres de moverse, lo que permite que el grafito conduzca la electricidad de manera muy efectiva, una característica necesaria para cualquier electrodo.
Alta inercia química
Como cátodo, el electrodo debe facilitar la transferencia de electrones a una sustancia en el electrolito sin reaccionar por sí mismo. El carbono es relativamente inerte, especialmente en comparación con la mayoría de los metales, lo que significa que no se corroerá ni interferirá con el proceso químico deseado.
Estabilidad térmica
El grafito tiene uno de los puntos de fusión/sublimación más altos de todos los elementos (alrededor de 3652°C o 6606°F). Esto lo hace perfecto para procesos electroquímicos de alta temperatura, como la electrólisis de sales fundidas, donde los electrodos metálicos se derretirían.
Bajo costo y disponibilidad
Desde una perspectiva industrial, el grafito es un material abundante y económico. Esto hace que la producción electroquímica a gran escala, que requiere electrodos grandes, sea económicamente factible.
Aplicaciones clave de los cátodos de grafito
Comprender los casos de uso específicos aclara la teoría. En cada ejemplo, el cátodo de grafito es simplemente el lugar donde se entregan los electrones para provocar un cambio químico.
Electrólisis de sales fundidas (Proceso Downs)
En la producción de sodio metálico puro a partir de cloruro de sodio fundido (NaCl), a menudo se utiliza una varilla de grafito como cátodo. Los iones de sodio cargados positivamente (Na⁺) son atraídos al cátodo cargado negativamente, donde ganan un electrón y se reducen a sodio metálico líquido.
Na⁺ + e⁻ → Na(l)
El cátodo de grafito simplemente proporciona la superficie y los electrones para esta reacción.
Electrólisis de soluciones acuosas (Salmuera)
Al electrolizar una solución acuosa de cloruro de sodio (salmuera), el cátodo de grafito juega un papel similar. Sin embargo, en este caso, el agua es más fácil de reducir que los iones de sodio.
Por lo tanto, las moléculas de agua se reducen en la superficie del cátodo de grafito, produciendo gas hidrógeno e iones hidróxido.
2H₂O(l) + 2e⁻ → H₂(g) + 2OH⁻(aq)
La pila seca de zinc-carbono
En una batería común de "servicio pesado", la varilla central está hecha de grafito y actúa como el cátodo (el terminal positivo). Está rodeada por una pasta húmeda de dióxido de manganeso (MnO₂) y otros productos químicos.
La varilla de grafito recolecta electrones del circuito externo. La reacción de reducción ocurre en la pasta adyacente a la varilla, donde se reduce el dióxido de manganeso. El grafito simplemente facilita este proceso.
Comprendiendo las compensaciones
Aunque es muy eficaz, el grafito no es un material perfecto. Reconocer sus limitaciones es clave para comprender sus aplicaciones.
Fragilidad
A diferencia de los metales, que son dúctiles, el grafito es quebradizo y puede fracturarse bajo golpes o tensiones mecánicas. Esto requiere un manejo y soporte cuidadosos en los diseños industriales.
Reactividad del ánodo vs. cátodo
Si bien el grafito es muy inerte como cátodo, puede consumirse cuando se usa como ánodo (el sitio de oxidación) en ciertos procesos. Por ejemplo, en la producción de aluminio, el ánodo de carbono reacciona con el oxígeno producido para formar gas CO₂ y se consume lentamente.
Confusión entre tipos de celdas
Un punto común de confusión es la polaridad del electrodo. El cátodo es siempre el sitio de reducción, pero su signo cambia según el tipo de celda.
- En una celda electrolítica (como para la electrólisis de sal), el cátodo es el terminal negativo.
- En una celda galvánica (como una batería), el cátodo es el terminal positivo.
Tomando la decisión correcta para su objetivo
Su razón para preguntar sobre los cátodos de grafito determina qué aspecto es más importante para enfocarse.
- Si su enfoque principal es la química básica: Recuerde que el grafito es un conductor inerte, que proporciona una superficie pasiva para que ocurra una reacción de reducción sin reaccionar por sí mismo.
- Si su enfoque principal son los procesos industriales: Elija el grafito por su rentabilidad y estabilidad inigualable en entornos de alta temperatura o corrosivos donde la mayoría de los metales fallarían.
- Si su enfoque principal es el estudio de baterías: Reconozca que la varilla de grafito en una pila de zinc-carbono actúa como el terminal positivo (cátodo), sirviendo como el colector de electrones que permite la reducción de la pasta química circundante.
En última instancia, comprender el papel del grafito como cátodo es reconocer el poder de un material inerte y conductor que permite la química sin interferir con ella.
Tabla resumen:
| Aplicación | Función del cátodo de grafito | Reacción clave |
|---|---|---|
| Electrólisis de sales fundidas (Proceso Downs) | Conductor inerte para la reducción de sodio | Na⁺ + e⁻ → Na(l) |
| Electrólisis de salmuera acuosa | Superficie para la reducción de agua | 2H₂O(l) + 2e⁻ → H₂(g) + 2OH⁻(aq) |
| Pila seca de zinc-carbono | Terminal positivo que permite la reducción de MnO₂ | Facilita la recolección de electrones |
¿Necesita electrodos de grafito de alto rendimiento para sus procesos electroquímicos? KINTEK se especializa en equipos y consumibles de laboratorio premium, incluidas varillas de grafito duraderas diseñadas para una conductividad superior y estabilidad térmica. Ya sea que esté realizando electrólisis industrial o desarrollando tecnologías de baterías, nuestros materiales garantizan un rendimiento confiable e inerte. Contacte a nuestros expertos hoy para encontrar la solución de grafito perfecta para las necesidades de su laboratorio.
Guía Visual
Productos relacionados
- Placa de grafito de carbono fabricada por el método de prensado isostático
- Material de pulido de electrodos para experimentos electroquímicos
- Horno de Grafización de Película de Alta Conductividad Térmica de Vacío de Grafito
- Horno Vertical de Vacío de Grafito de Alta Temperatura para Grafización
- Horno de grafización de vacío de grafito vertical grande
La gente también pregunta
- ¿Cómo se debe manipular un electrodo de disco de oro durante un experimento? Asegure mediciones electroquímicas precisas
- ¿Cuáles son las funciones de los electrodos de Pt y Ag/AgCl en las pruebas de Sb2S3? Optimice su investigación fotoelectroquímica
- ¿Para qué se utiliza el carbono vítreo? Una guía de sus propiedades únicas y aplicaciones clave
- ¿Cuáles son las ventajas técnicas de usar platino como material de electrodo en la electrólisis del agua? | KINTEK
- ¿Qué pretratamiento se requiere antes de usar un electrodo de malla de platino? Una guía para obtener resultados electroquímicos fiables
- ¿Por qué se utiliza una lámina de platino (Pt) como contraelectrodo en un sistema de prueba electroquímica de tres electrodos?
- ¿Cuáles son los tipos disponibles de electrodos de referencia de sulfato de cobre? Explicación de madera frente a núcleo cerámico
- ¿Por qué se selecciona el carbono vítreo para la oxidación indirecta asistida por mediador del glicerol? La clave para una investigación imparcial



















