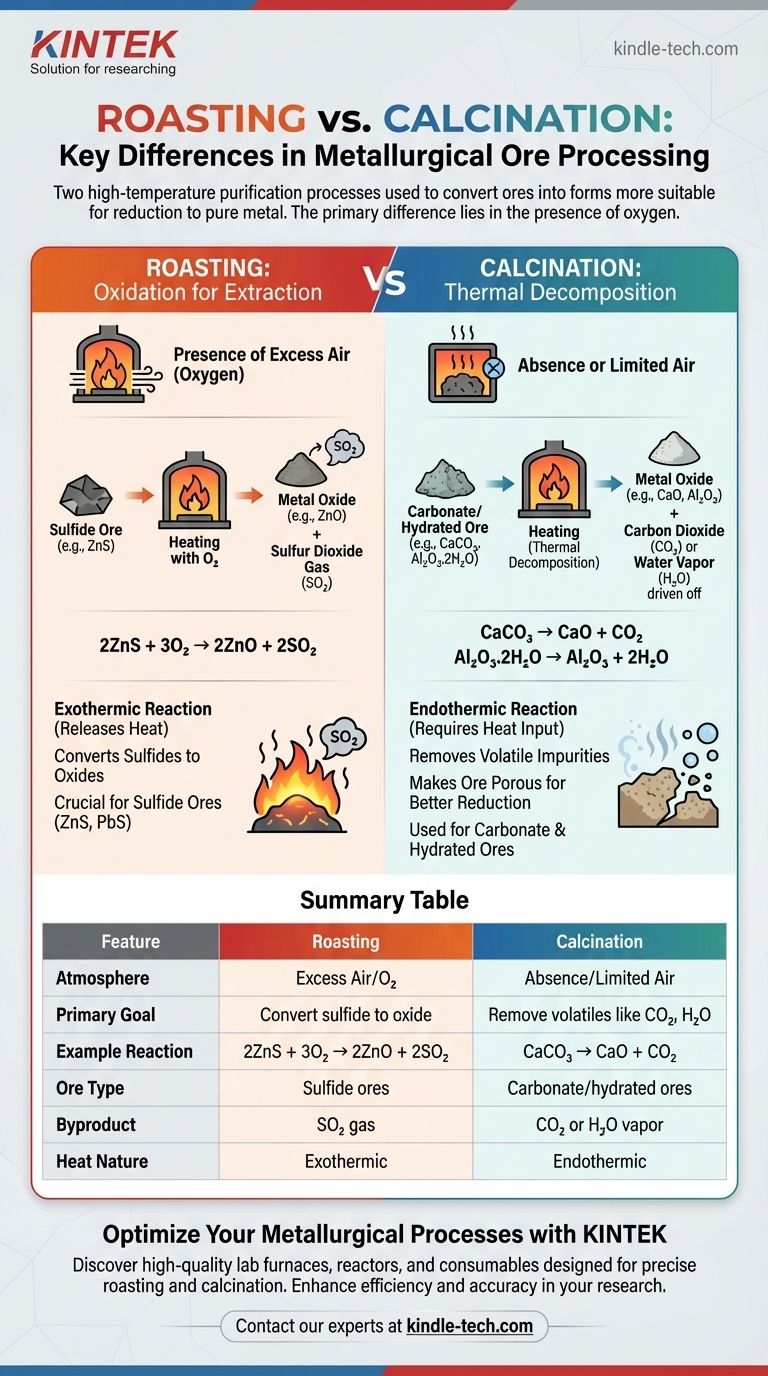
En esencia, la diferencia principal entre la tostación y la calcinación radica en la presencia de oxígeno. La tostación es el proceso de calentar un mineral concentrado a alta temperatura en presencia de un exceso de aire. En contraste, la calcinación implica calentar un mineral a alta temperatura ya sea en ausencia de aire o con un suministro muy limitado. Ambos son pasos preliminares cruciales en metalurgia diseñados para convertir los minerales en una forma más adecuada para la reducción al metal puro.
Si bien ambos son procesos de purificación a alta temperatura, la tostación utiliza oxígeno para convertir químicamente los minerales sulfurados en óxidos. La calcinación, por otro lado, utiliza solo calor para descomponer térmicamente los minerales carbonatados o hidratados, eliminando sustancias volátiles como el dióxido de carbono y el agua.

Comprender la Tostación: Oxidación para la Extracción
La tostación es un proceso pirometalúrgico clave, lo que significa que utiliza calor para provocar cambios químicos en un mineral. Su aplicación principal es para minerales sulfurados.
El Objetivo Fundamental
El propósito principal de la tostación es convertir un sulfuro metálico en un óxido metálico. Los óxidos metálicos son significativamente más fáciles y económicamente viables de reducir a metal puro que sus contrapartes sulfuradas.
La Reacción Química y el Ejemplo
Durante la tostación, el mineral reacciona con el oxígeno del aire. Esto convierte el sulfuro metálico en un óxido metálico y produce gas dióxido de azufre (SO₂) como subproducto.
Un ejemplo clásico es la tostación de blenda de zinc (ZnS) para producir óxido de zinc (ZnO), un paso crucial en la extracción de zinc:
2ZnS + 3O₂ → 2ZnO + 2SO₂
Características Clave de la Tostación
Este proceso se realiza en un horno especializado, como un horno de reverbero o de llama, a una temperatura inferior al punto de fusión del mineral. Para muchos minerales sulfurados, la reacción es exotérmica, lo que significa que libera calor y puede sostenerse una vez iniciada.
Comprender la Calcinación: Descomposición Térmica
La calcinación es otro proceso de tratamiento térmico, pero su mecanismo químico es completamente diferente. Se utiliza principalmente para minerales carbonatados e hidratados.
El Objetivo Fundamental
El objetivo de la calcinación es eliminar impurezas volátiles calentando el mineral. Esto elimina sustancias como el dióxido de carbono (de los carbonatos) o el agua (de los óxidos hidratados), dejando atrás un óxido metálico más concentrado.
La Reacción Química y el Ejemplo
La calcinación es una reacción de descomposición térmica que ocurre en ausencia de aire. Un ejemplo principal es la calcinación de piedra caliza (carbonato de calcio, CaCO₃) para producir cal (óxido de calcio, CaO):
CaCO₃ → CaO + CO₂
Otro uso común es para minerales hidratados, como la bauxita (óxido de aluminio hidratado), para eliminar el agua antes del proceso de extracción de aluminio:
Al₂O₃.2H₂O → Al₂O₃ + 2H₂O
Características Clave de la Calcinación
Este proceso es endotérmico, requiere una entrada continua de calor. Hace que el mineral sea poroso, lo que aumenta el área superficial disponible para el paso de reducción posterior, aumentando así su eficiencia.
Comprender las Compensaciones y el Contexto
Elegir entre estos procesos no es una cuestión de preferencia; está dictado por la química del mineral. Comprender el porqué es clave para entender la metalurgia.
¿Por qué no reducir los sulfuros directamente?
Reducir los sulfuros metálicos directamente a metal es termodinámicamente difícil y costoso. Convertirlos primero en óxidos proporciona una vía mucho más eficiente y rentable para la reducción, utilizando típicamente carbono (coque) como agente reductor.
Manejo de los Subproductos
La tostación produce dióxido de azufre (SO₂), un gas que puede causar lluvia ácida si se libera a la atmósfera. Las plantas metalúrgicas modernas capturan este gas y lo utilizan para fabricar ácido sulfúrico, convirtiendo un pasivo ambiental potencial en un producto comercial valioso.
La Importancia de un Mineral Poroso
La capacidad de la calcinación para crear un mineral poroso y quebradizo es una ventaja significativa. Esta mayor área superficial permite que el agente reductor (como el monóxido de carbono en un alto horno) interactúe de manera más efectiva con el óxido metálico, acelerando la extracción final del metal.
Tomar la Decisión Correcta para su Mineral
La elección entre tostación y calcinación está dictada enteramente por la composición química del mineral que necesita procesar.
- Si su mineral es un sulfuro (como blenda de zinc, ZnS, o galena, PbS): Debe usar tostación para convertir el sulfuro en un óxido antes de que pueda reducirse al metal puro.
- Si su mineral es un carbonato (como calamina, ZnCO₃, o piedra caliza, CaCO₃): Debe usar calcinación para descomponerlo térmicamente y eliminar el dióxido de carbono, produciendo el óxido metálico.
- Si su mineral es un óxido hidratado (como bauxita, Al₂O₃.2H₂O): Debe usar calcinación para eliminar el agua químicamente ligada y producir un óxido anhidro puro.
Comprender esta distinción fundamental es el primer paso para diseñar un proceso de extracción metalúrgica eficaz y eficiente.
Tabla Resumen:
| Característica | Tostación | Calcinación |
|---|---|---|
| Atmósfera | Exceso de aire (presencia de O₂) | Ausencia o aire limitado |
| Objetivo Principal | Convertir minerales sulfurados en óxidos | Eliminar impurezas volátiles (CO₂, H₂O) |
| Reacción de Ejemplo | 2ZnS + 3O₂ → 2ZnO + 2SO₂ | CaCO₃ → CaO + CO₂ |
| Tipo de Mineral | Minerales sulfurados (ej. ZnS, PbS) | Minerales carbonatados/hidratados (ej. CaCO₃, bauxita) |
| Subproducto | Gas SO₂ | Vapor de CO₂ o H₂O |
| Naturaleza del Calor | Exotérmica (libera calor) | Endotérmica (requiere aporte de calor) |
Optimice sus Procesos Metalúrgicos con KINTEK
Ya sea que esté procesando minerales sulfurados mediante tostación o descomponiendo carbonatos mediante calcinación, contar con el equipo de laboratorio adecuado es crucial para la eficiencia y la precisión. KINTEK se especializa en proporcionar hornos de laboratorio, reactores y consumibles de alta calidad diseñados para satisfacer las rigurosas demandas de las pruebas e investigación metalúrgicas.
Nuestros productos garantizan un control preciso de la temperatura, calentamiento uniforme y durabilidad, factores clave para el éxito de las operaciones de tostación y calcinación. Al asociarse con KINTEK, usted obtiene acceso a:
- Equipos confiables que mejoran la reproducibilidad del proceso
- Soporte experto para ayudarle a seleccionar las herramientas adecuadas para su tipo específico de mineral
- Soluciones que mejoran la seguridad y el cumplimiento ambiental
¿Listo para refinar su proceso de extracción? Contacte a nuestros expertos hoy mismo para discutir cómo el equipo de laboratorio de KINTEK puede apoyar sus innovaciones metalúrgicas e impulsar su investigación.
Guía Visual
Productos relacionados
- Horno de Tubo de Cuarzo para Procesamiento Térmico Rápido (RTP) de Laboratorio
- Horno Tubular de Laboratorio de Alta Temperatura de 1700℃ con Tubo de Alúmina
- Horno de Grafización de Película de Alta Conductividad Térmica de Vacío de Grafito
- Horno de mufla de 1700℃ para laboratorio
- Horno de Tratamiento Térmico al Vacío con Revestimiento de Fibra Cerámica
La gente también pregunta
- ¿Qué papel juega un horno de tubo de cuarzo en la síntesis de hBN? Optimice sus resultados de deposición química de vapor
- ¿Cuál es el valor técnico de usar una cámara de reacción de tubo de cuarzo para pruebas de corrosión estática? Lograr precisión.
- ¿Cómo garantiza un horno tubular industrial las condiciones de proceso requeridas para los dispositivos experimentales de fluidos supercríticos?
- ¿Qué sucede cuando se calienta el cuarzo? Una guía sobre sus transiciones de fase críticas y usos
- ¿Por qué los tubos de cuarzo son preferidos para la combustión de polvo de cromo? Resistencia superior al calor y claridad óptica



















