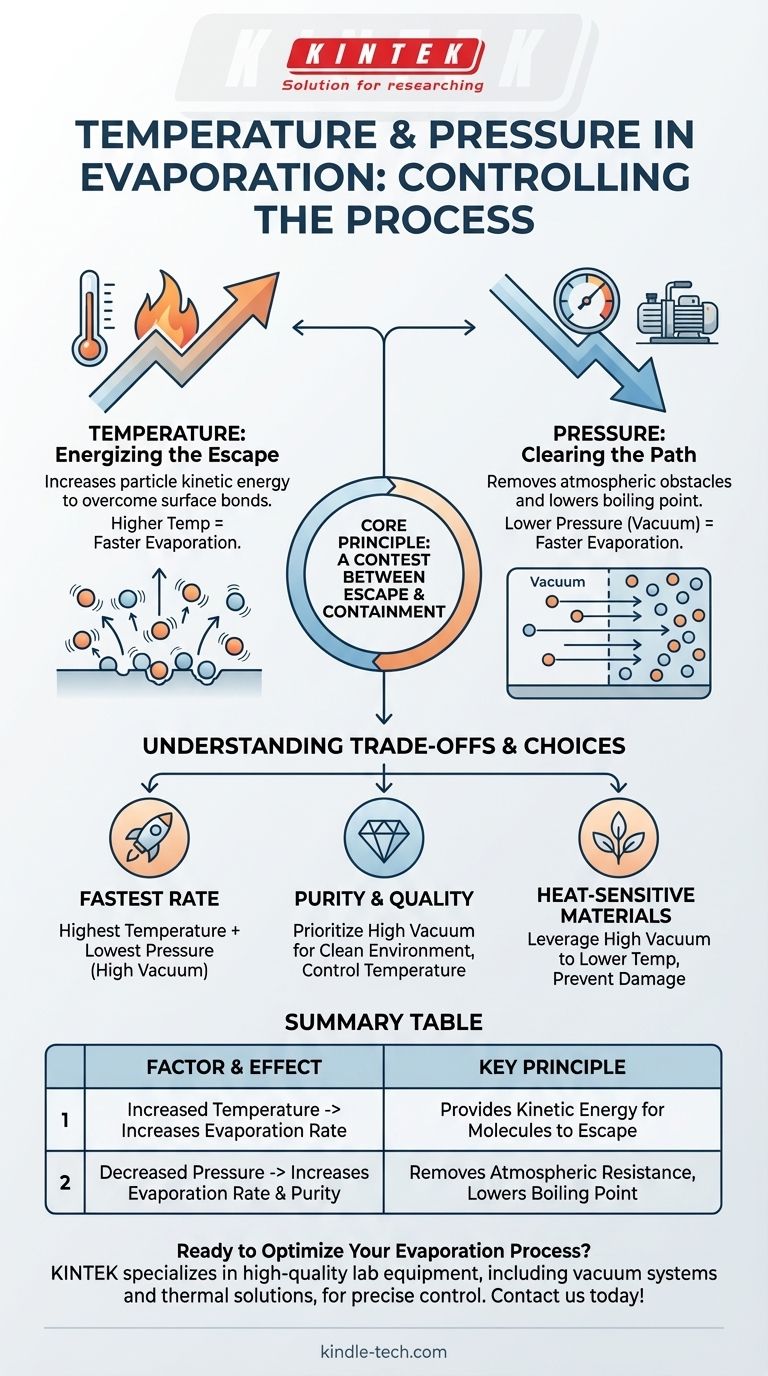
En cualquier proceso de evaporación, la temperatura y la presión son las dos palancas principales de control. Aumentar la temperatura proporciona a las moléculas la energía para escapar de una superficie, aumentando así la tasa de evaporación. Por el contrario, disminuir la presión ambiental elimina los obstáculos atmosféricos, lo que también aumenta significativamente la tasa de evaporación.
El principio central es una contienda entre el escape y la contención. La temperatura da a las moléculas la energía para escapar, mientras que una presión más baja elimina las fuerzas externas que las contienen, haciendo que todo el proceso sea más rápido y eficiente.

El papel de la temperatura: energizar el escape
La temperatura es la forma más directa de influir en la rapidez con la que se evapora un material. La relación se basa en la energía de los átomos o moléculas individuales.
La energía cinética es clave
La temperatura es fundamentalmente una medida de la energía cinética promedio (la energía del movimiento) de las partículas en una sustancia.
Cuando calienta un material, está aumentando la velocidad y la vibración de sus partículas constituyentes.
Superar los enlaces superficiales
Para que una partícula se evapore, debe tener suficiente energía para romper los enlaces que la sujetan a la superficie del material.
Las temperaturas más altas significan que un mayor porcentaje de partículas posee esta "velocidad de escape" necesaria, lo que conduce a una mayor tasa general de evaporación.
Aplicación en la deposición de materiales
En procesos como la deposición de películas delgadas, calentar el sustrato objetivo es fundamental. Como se mencionó, calentar por encima de 150 °C asegura una buena adhesión.
Esto se debe a que los átomos depositados llegan con suficiente energía térmica para moverse ligeramente sobre la superficie, asentándose en una estructura cristalina estable, uniforme y bien unida.
El papel de la presión: despejar el camino
Mientras que la temperatura proporciona el "empuje" para la evaporación, la presión ambiental proporciona el "empuje hacia atrás". Gestionar esta presión externa es a menudo igual de importante.
Resistencia atmosférica
El aire o gas por encima de una superficie ejerce presión, creando una capa de partículas que un átomo en evaporación debe atravesar.
A presión atmosférica estándar, una partícula en evaporación colisionará con miles de millones de moléculas de aire, lo que ralentizará su progreso e incluso la hará retroceder hacia la superficie.
El poder de un vacío
Disminuir la presión, o crear un vacío, elimina estas partículas atmosféricas. Esto despeja el camino para los átomos en evaporación.
En un alto vacío, un átomo puede viajar en línea recta desde su fuente hasta su destino (como un sustrato) con una menor probabilidad de colisión, lo que aumenta drásticamente la tasa neta de evaporación.
Reducción del punto de ebullición
Un efecto crítico de la reducción de la presión es que reduce el punto de ebullición del material. La ebullición es simplemente una evaporación rápida que ocurre cuando la presión de vapor interna de un material iguala la presión ambiental externa.
Al crear un vacío, puede hacer que los materiales se evaporen o hiervan a temperaturas mucho más bajas de lo que sería posible en el aire libre. Esto es esencial para procesar materiales sensibles al calor.
Comprender las compensaciones
Controlar la temperatura y la presión permite resultados precisos, pero requiere equilibrar factores en competencia.
Pureza frente a tasa
En una cámara de vacío, el objetivo a menudo no es solo una alta tasa, sino también una alta pureza. Una presión más baja asegura que haya menos moléculas de gas contaminantes (como oxígeno o nitrógeno) presentes para interferir o incrustarse en la película depositada final.
Costos de energía frente a costos de equipo
Alcanzar altas temperaturas requiere una entrada de energía significativa. Lograr un alto vacío requiere sistemas de bombeo caros y complejos.
La elección a menudo depende de las propiedades del material. Puede ser más eficiente usar un vacío moderado y una temperatura más alta para un material robusto, o un alto vacío y una temperatura más baja para uno delicado.
Tomar la decisión correcta para su objetivo
La configuración óptima de temperatura y presión depende totalmente de lo que esté tratando de lograr con el proceso de evaporación.
- Si su enfoque principal es la tasa de evaporación más rápida posible: Utilice la temperatura más alta que el material pueda tolerar combinada con la presión más baja posible (vacío más alto).
- Si su enfoque principal es la pureza del material y la calidad de la película: Priorice lograr un alto vacío para crear un ambiente limpio, y luego aplique cuidadosamente la temperatura para controlar la tasa de deposición.
- Si su enfoque principal es procesar un material sensible al calor: Aproveche un alto vacío para reducir significativamente la temperatura de evaporación, evitando así el daño térmico a la sustancia.
En última instancia, dominar la evaporación consiste en comprender cómo utilizar la temperatura y la presión en concierto para lograr sus objetivos materiales específicos.
Tabla de resumen:
| Factor | Efecto sobre la evaporación | Principio clave |
|---|---|---|
| Aumento de la temperatura | Aumenta la tasa de evaporación | Proporciona energía cinética para que las moléculas escapen de la superficie |
| Disminución de la presión | Aumenta la tasa de evaporación y la pureza | Elimina la resistencia atmosférica, reduce el punto de ebullición |
¿Listo para optimizar su proceso de evaporación?
Comprender la interacción de la temperatura y la presión es crucial para lograr resultados precisos en su laboratorio. Ya sea que necesite maximizar la pureza, proteger materiales sensibles al calor o aumentar las tasas de deposición, contar con el equipo adecuado es clave.
KINTEK se especializa en equipos de laboratorio de alta calidad, incluidos sistemas de vacío y soluciones térmicas, diseñados para brindarle un control preciso sobre sus procesos. Nuestros expertos pueden ayudarle a seleccionar la configuración ideal para su aplicación específica, garantizando eficiencia, confiabilidad y resultados superiores.
¡Contáctenos hoy para discutir sus necesidades y descubrir cómo KINTEK puede mejorar las capacidades de su laboratorio!
Guía Visual
Productos relacionados
- Prensa Térmica Hidráulica Eléctrica Calefactada al Vacío para Laboratorio
- Máquina de prensa hidráulica con calentamiento y placas calientes para prensa en caliente de laboratorio con caja de vacío
- Prensa de Calentamiento de Doble Placa para Laboratorio
- Máquina de prensa hidráulica calentada con placas calentadas para prensa en caliente de laboratorio de caja de vacío
- Horno de Prensado en Caliente al Vacío Máquina de Prensado al Vacío Calentado
La gente también pregunta
- ¿Cómo influyen los hornos de precisión automatizados en la evolución estructural del Zr1Nb? Dominio de la hidrogenación y la poligonización
- ¿Qué hace el prensado en caliente? Transformar materiales con densificación a alta temperatura y alta presión
- ¿Para qué se utilizan las prensas en caliente? Transformando materiales con calor y presión
- ¿Cómo afecta la temperatura a la presión de vacío? Domine la clave para el control del sistema
- ¿Cuál es el propósito de una base calefactada con succión de vacío? Mejora la precisión del recubrimiento de MEA y el rendimiento del catalizador



















