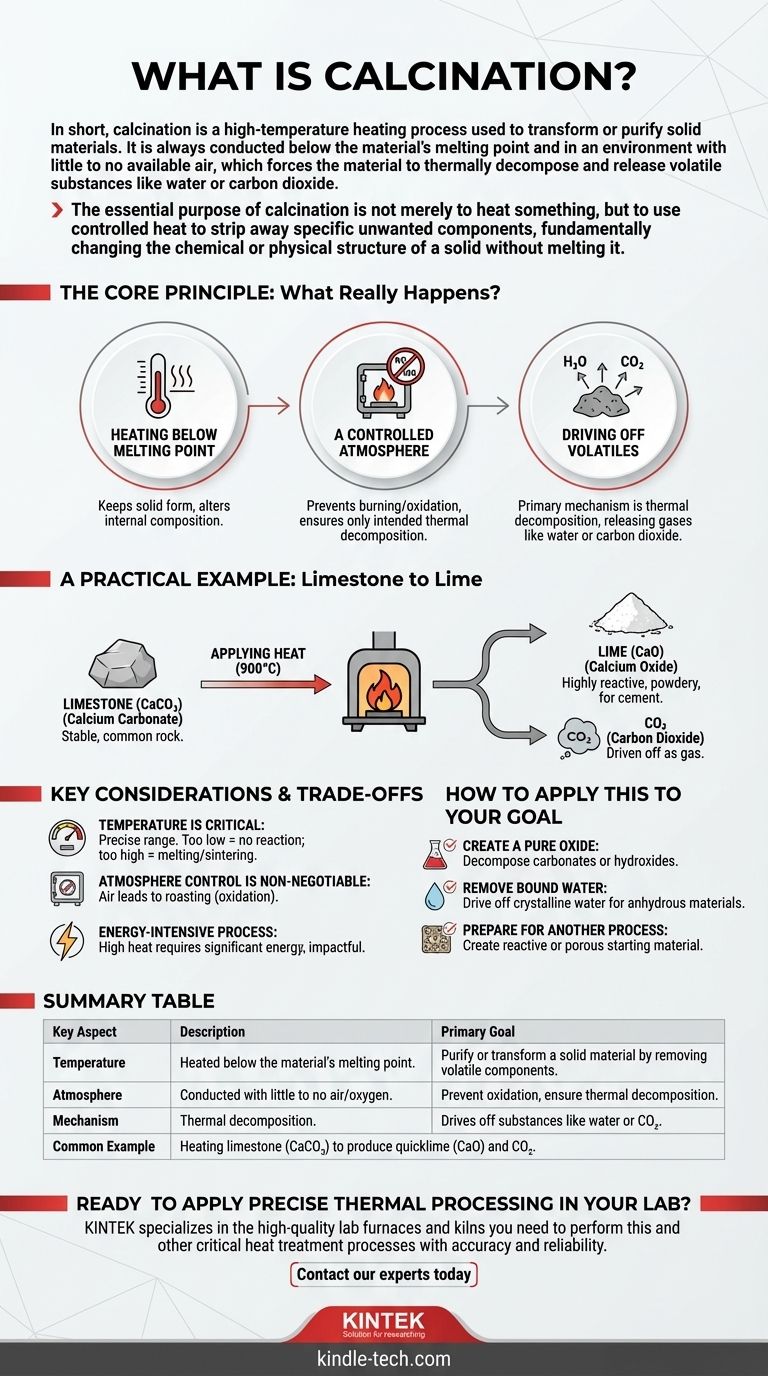
En resumen, la calcinación es un proceso de calentamiento a alta temperatura utilizado para transformar o purificar materiales sólidos. Siempre se lleva a cabo por debajo del punto de fusión del material y en un ambiente con poco o ningún aire disponible, lo que obliga al material a descomponerse térmicamente y liberar sustancias volátiles como agua o dióxido de carbono.
El propósito esencial de la calcinación no es simplemente calentar algo, sino utilizar calor controlado para eliminar componentes no deseados específicos, cambiando fundamentalmente la estructura química o física de un sólido sin fundirlo.

El Principio Central: ¿Qué Sucede Realmente Durante la Calcinación?
Para entender la calcinación, es crucial mirar más allá del simple acto de calentar. El proceso se define por tres condiciones específicas que trabajan juntas para lograr un resultado preciso.
Calentamiento por Debajo del Punto de Fusión
El objetivo es inducir cambios químicos o físicos dentro del material sólido en sí. Al mantener la temperatura por debajo de su punto de fusión, se mantiene la forma sólida general del material mientras se altera su composición interna.
Una Atmósfera Controlada
La calcinación se realiza en ausencia o con un suministro muy limitado de aire (oxígeno). Esta es una distinción crítica. Evita que el material se queme u oxide, asegurando que la única reacción que tenga lugar sea la descomposición térmica prevista.
Eliminación de Volátiles
El mecanismo principal es la descomposición térmica. El calor aplicado proporciona la energía necesaria para romper los enlaces químicos, forzando al material a liberar fracciones volátiles. Estas son típicamente sustancias que pueden convertirse en gas, como el agua (H₂O) o el dióxido de carbono (CO₂).
Un Ejemplo Práctico: De la Caliza a la Cal Viva
El ejemplo más común y fácil de entender de la calcinación es su papel en la producción de cal para la industria del cemento.
El Material de Partida: Caliza
El proceso comienza con la caliza, que químicamente se conoce como carbonato de calcio (CaCO₃). Es una roca estable y común.
El Proceso: Aplicación de Calor
La caliza se calienta en un horno grande a temperaturas de alrededor de 900 °C (1650 °F). Este calor intenso descompone el carbonato de calcio.
Los Productos Finales: Cal Viva y CO₂
El proceso de calcinación elimina el dióxido de carbono (CO₂) como gas, dejando atrás una sustancia pulverulenta altamente reactiva conocida como óxido de calcio (CaO), o cal viva. Esta cal resultante es un ingrediente fundamental en el cemento y otras aplicaciones industriales.
Consideraciones Clave y Compensaciones
Aunque es potente, la calcinación es un proceso que requiere precisión. La incomprensión de sus requisitos centrales puede conducir a resultados fallidos o ineficientes.
La Temperatura es Crítica
El proceso opera dentro de una ventana de temperatura específica. Si la temperatura es demasiado baja, la reacción de descomposición no se producirá. Si es demasiado alta, el material podría fundirse o sinterizarse (fusionarse en una masa sólida), lo que puede ser indeseable para la aplicación final.
El Control de la Atmósfera No Es Negociable
Permitir la entrada de aire sin control en el horno cambiaría el proceso por completo. Por ejemplo, calentar un sulfuro metálico en presencia de aire se denomina tostación, un proceso de oxidación con un resultado completamente diferente al de la calcinación.
Es un Proceso Intensivo en Energía
Calentar grandes cantidades de material a temperaturas tan altas requiere una cantidad significativa de energía. Esto hace que la calcinación sea un paso costoso y con impacto ambiental en cualquier flujo de trabajo industrial.
Cómo Aplicar Esto a Su Objetivo
Comprender cuándo y por qué usar la calcinación es clave para aprovecharla de manera efectiva en la ciencia de los materiales, la química y la ingeniería.
- Si su enfoque principal es crear un óxido puro: La calcinación es el método definitivo para descomponer carbonatos (como la caliza) o hidróxidos para producir sus óxidos correspondientes.
- Si su enfoque principal es eliminar el agua ligada: El proceso se utiliza para eliminar el agua cristalina de los minerales hidratados, creando una versión anhidra (sin agua) del material.
- Si su enfoque principal es preparar un material para otro proceso: La calcinación es a menudo un paso preparatorio crucial para crear un material de partida más reactivo o poroso para reacciones químicas posteriores.
En última instancia, la calcinación es una herramienta industrial precisa para utilizar calor controlado para purificar y transformar fundamentalmente materiales sólidos.
Tabla Resumen:
| Aspecto Clave | Descripción |
|---|---|
| Objetivo Principal | Purificar o transformar un material sólido eliminando componentes volátiles. |
| Temperatura | Calentado por debajo del punto de fusión del material. |
| Atmósfera | Realizado con poco o ningún aire/oxígeno para prevenir la oxidación. |
| Mecanismo | La descomposición térmica elimina sustancias como agua o CO₂. |
| Ejemplo Común | Calentar caliza (CaCO₃) para producir cal viva (CaO) y CO₂. |
¿Listo para aplicar procesamiento térmico preciso en su laboratorio?
La calcinación es un paso fundamental para crear óxidos puros, eliminar agua y preparar materiales reactivos. KINTEK se especializa en los hornos y muflas de laboratorio de alta calidad que necesita para realizar este y otros tratamientos térmicos críticos con precisión y fiabilidad.
Contacte a nuestros expertos hoy mismo para encontrar la solución de calcinación perfecta para los materiales y objetivos específicos de su laboratorio.
Guía Visual
Productos relacionados
- Horno Tubular de Laboratorio de Alta Temperatura de 1700℃ con Tubo de Alúmina
- Horno de Grafización de Película de Alta Conductividad Térmica de Vacío de Grafito
- Horno de mufla de 1700℃ para laboratorio
- Horno de grafización al vacío a ultra alta temperatura de grafito
- Horno de Sinterización y Soldadura Fuerte por Tratamiento Térmico al Vacío
La gente también pregunta
- ¿Cuál es la temperatura alta de un tubo cerámico? De 1100 °C a 1800 °C, elija el material adecuado
- ¿Cómo limpiar un horno tubular? Una guía paso a paso para un mantenimiento seguro y eficaz
- ¿Cuáles son los peligros de un horno tubular? Más allá de los riesgos obvios de quemaduras
- ¿Cómo simula un horno de tubo de alúmina con atmósfera controlada las condiciones en entornos CSP? Domina la precisión.
- ¿Cuáles son las ventajas de utilizar un revestimiento de alúmina en un horno tubular para simulaciones de corrosión por combustión de biomasa?



















