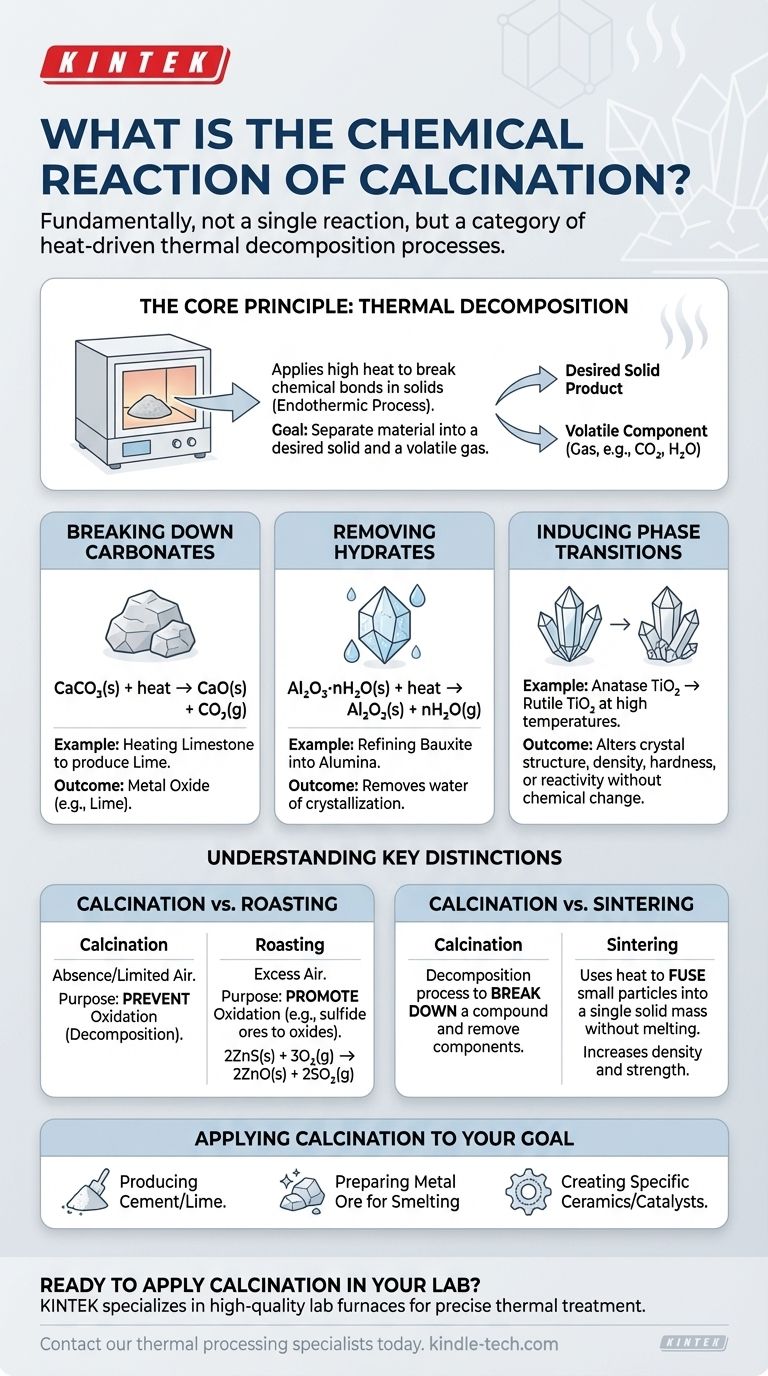
Fundamentalmente, la calcinación no es una única reacción química, sino más bien una categoría de procesos impulsados por el calor definidos por un resultado específico: la descomposición térmica. Si bien muchas reacciones entran en este paraguas, el ejemplo más común es la descomposición de un carbonato, como calentar piedra caliza (carbonato de calcio) para producir cal (óxido de calcio) y dióxido de carbono gaseoso.
La calcinación es un proceso de tratamiento térmico que utiliza calor intenso en una atmósfera controlada para descomponer un material. Su propósito principal es eliminar un componente volátil, como dióxido de carbono o agua, para purificar o alterar las propiedades químicas y físicas del sólido restante.

El Principio Central: Descomposición Térmica
La calcinación funciona aplicando suficiente energía térmica a un sólido para romper sus enlaces químicos. Este proceso es siempre endotérmico, lo que significa que requiere una entrada de energía (calor) para llevarse a cabo. El objetivo es separar el material en un producto sólido deseado y un componente volátil que pueda eliminarse como gas.
Descomposición de Carbonatos
Esta es la aplicación clásica y más extendida de la calcinación, particularmente en la producción de cemento. Cuando se calienta un carbonato metálico, se descompone en un óxido metálico y dióxido de carbono gaseoso.
Para la piedra caliza, la reacción es:
CaCO₃(s) + calor → CaO(s) + CO₂(g)
Aquí, el carbonato de calcio sólido se descompone en óxido de calcio sólido (cal) y dióxido de carbono gaseoso.
Eliminación de Hidratos (Agua de Cristalización)
Muchos minerales existen como hidratos, lo que significa que las moléculas de agua están incorporadas en su estructura cristalina. La calcinación se utiliza para eliminar esta agua, un proceso a menudo denominado "secado", aunque es una descomposición química.
Por ejemplo, refinar el mineral de bauxita a alúmina implica calcinar el óxido de aluminio hidratado:
Al₂O₃·nH₂O(s) + calor → Al₂O₃(s) + nH₂O(g)
Este paso elimina el agua, concentrando el óxido de aluminio, que es un precursor necesario para producir aluminio metálico.
Inducción de Transiciones de Fase
Menos comúnmente, la calcinación puede referirse a un proceso en el que el calor no provoca la descomposición, sino que cambia la estructura cristalina (fase) de un material. Esto altera sus propiedades físicas, como la densidad, la dureza o la reactividad, sin cambiar su fórmula química.
Un ejemplo es la conversión de anatasa, una forma de dióxido de titanio (TiO₂), a su fase rutilo más estable a altas temperaturas.
Comprensión de las Distinciones Clave
El valor de la calcinación se hace más claro cuando se contrasta con otros procesos térmicos comunes. Las condiciones específicas, particularmente la atmósfera, definen el resultado.
Calcinación frente a Tostado
Esta es la distinción más crítica. La calcinación ocurre en ausencia o suministro limitado de aire para prevenir intencionalmente la oxidación.
El tostado, por el contrario, se realiza en exceso de aire específicamente para promover la oxidación. Se utiliza típicamente en minerales sulfurosos, convirtiéndolos en óxidos. Por ejemplo, tostar sulfuro de zinc:
2ZnS(s) + 3O₂(g) → 2ZnO(s) + 2SO₂(g)
Calcinación frente a Sinterización
Estos procesos tienen objetivos opuestos. La calcinación es un proceso de descomposición utilizado para descomponer un compuesto y eliminar un componente.
La sinterización, sin embargo, utiliza calor (por debajo del punto de fusión) para fusionar partículas pequeñas en una sola masa sólida. Aumenta la densidad y la resistencia, esencialmente "soldando" el material sin fundirlo.
Aplicación de la Calcinación a su Objetivo
La reacción de calcinación específica que le interesa depende totalmente de su material de partida y del producto final deseado.
- Si su enfoque principal es la producción de cemento o cal: Está utilizando la calcinación para descomponer el carbonato de calcio en óxido de calcio reactivo.
- Si su enfoque principal es preparar un mineral metálico para la fundición: Probablemente esté utilizando la calcinación para eliminar agua (de hidratos) o dióxido de carbono (de carbonatos) para enriquecer el contenido metálico.
- Si su enfoque principal es crear una cerámica o catalizador específico: Es posible que esté utilizando la calcinación para lograr una fase cristalina y un área superficial deseadas en un material como la alúmina o la titania.
En última instancia, la calcinación es una herramienta fundamental en la ciencia de los materiales para transformar sólidos en bruto en formas más útiles, concentradas o reactivas.
Tabla de Resumen:
| Tipo de Reacción de Calcinación | Reacción de Ejemplo | Resultado Clave |
|---|---|---|
| Descomposición de Carbonato | CaCO₃(s) + calor → CaO(s) + CO₂(g) |
Produce óxido metálico (ej. cal) |
| Descomposición de Hidrato | Al₂O₃·nH₂O(s) + calor → Al₂O₃(s) + nH₂O(g) |
Elimina el agua de cristalización |
| Transición de Fase | Anatasa TiO₂ → Rutilo TiO₂ | Altera la estructura cristalina y las propiedades |
¿Listo para aplicar la calcinación en su laboratorio?
Ya sea que esté desarrollando nuevos catalizadores, procesando minerales o sintetizando cerámicas avanzadas, el tratamiento térmico preciso es fundamental. KINTEK se especializa en hornos de laboratorio y equipos de alta calidad diseñados para procesos de calcinación fiables.
Proporcionamos las herramientas que necesita para lograr un calentamiento uniforme, un control preciso de la temperatura y resultados consistentes. Permita que nuestros expertos le ayuden a seleccionar el equipo adecuado para su material y aplicación específicos.
Póngase en contacto con nuestros especialistas en procesamiento térmico hoy mismo para analizar los requisitos de su proyecto y descubrir cómo KINTEK puede mejorar su investigación y desarrollo.
Guía Visual
Productos relacionados
- Planta de Horno de Pirólisis de Horno Rotatorio Eléctrico Máquina Calcinadora Horno Rotatorio Pequeño Horno Giratorio
- Horno Rotatorio Eléctrico de Trabajo Continuo, Pequeña Planta de Pirólisis con Calefacción de Horno Rotatorio
- Horno Rotatorio Eléctrico Pequeño Horno Rotatorio para Regeneración de Carbón Activado
- Horno de Tubo Rotatorio Continuo Sellado al Vacío Horno de Tubo Giratorio
- Horno de Tubo de Cuarzo para Procesamiento Térmico Rápido (RTP) de Laboratorio
La gente también pregunta
- ¿Qué biomasa se utiliza en la pirólisis? Selección del material de partida óptimo para sus objetivos
- ¿Cuáles son las zonas del horno rotatorio en la producción de cemento? Domine el proceso central para un clínker de alta calidad
- ¿Qué equipo se utiliza en la pirólisis? Elegir el reactor adecuado para su materia prima y sus productos
- ¿Cuál es la diferencia entre calcinación y tostación? Una guía para el procesamiento a alta temperatura
- ¿Cuál es el principio del horno rotatorio? Dominando el Procesamiento Térmico Continuo



















