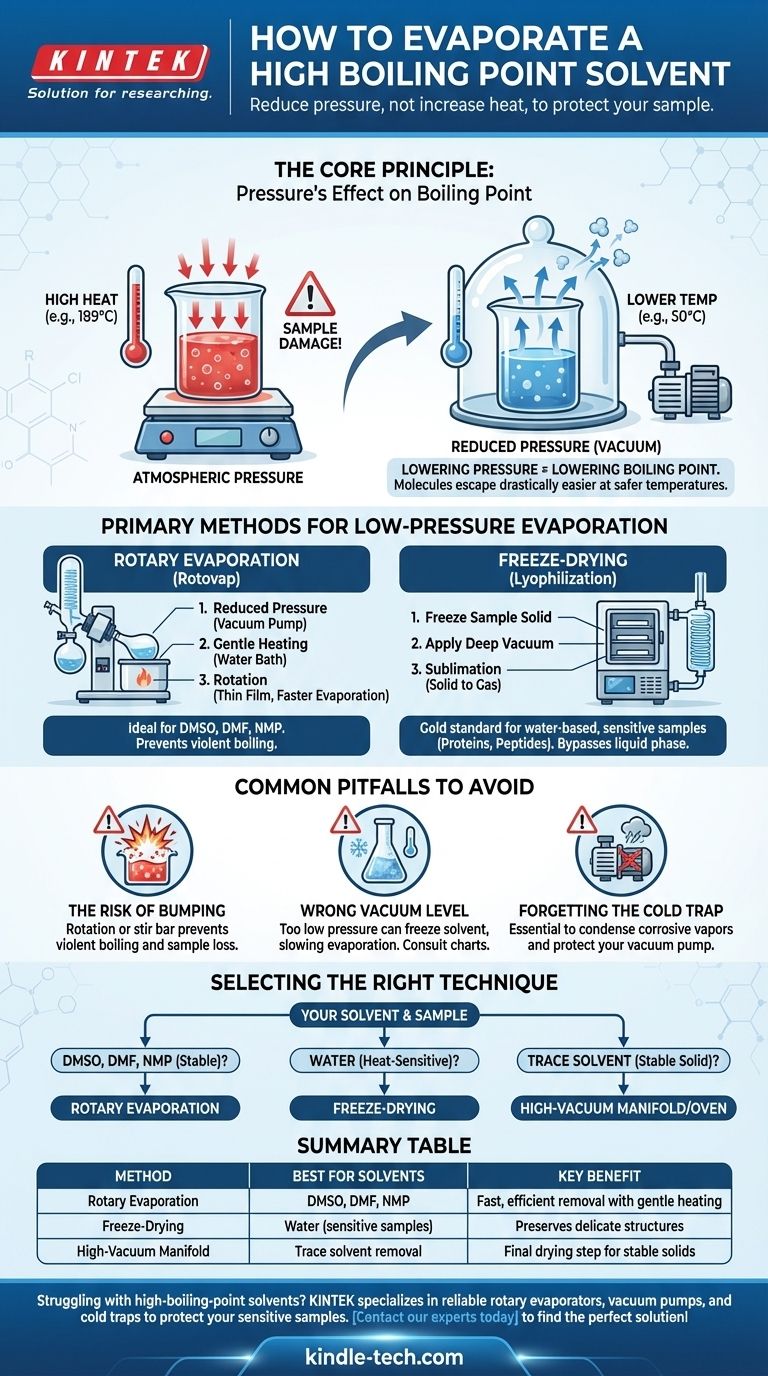
La evaporación de un disolvente de alto punto de ebullición es un desafío común en el laboratorio donde simplemente añadir más calor a menudo es contraproducente y puede destruir su muestra. La solución no es forzar la evaporación con altas temperaturas, sino cambiar el entorno reduciendo significativamente la presión. Esto reduce el punto de ebullición del disolvente, permitiendo que se vaporice suave y eficientemente a una temperatura mucho más segura y baja.
El principio fundamental es este: en lugar de luchar contra el alto punto de ebullición del disolvente con calor destructivo, se cambian las reglas del juego. Al aplicar un vacío, se facilita drásticamente que las moléculas del disolvente escapen, lo que permite una rápida evaporación a temperatura ambiente o cercana a ella.

El Principio Central: El Efecto de la Presión en el Punto de Ebullición
Para eliminar eficazmente un disolvente de alto punto de ebullición, primero debe comprender la física en juego. El proceso se rige completamente por la relación entre la temperatura, la presión y el estado físico del disolvente.
¿Qué Define un Punto de Ebullición?
Un líquido hierve a la temperatura a la que su presión de vapor —la presión ejercida por su forma gaseosa— iguala la presión del entorno que lo rodea.
A nivel del mar, el agua hierve a 100 °C porque esa es la temperatura a la que su presión de vapor iguala la presión atmosférica estándar (~760 torr).
La Relación Presión-Temperatura
La idea clave es que si se puede reducir la presión ambiental, también se reduce la temperatura necesaria para que el disolvente hierva.
Piénselo como quitar una tapa pesada de un recipiente. Con menos presión empujando sobre la superficie del líquido, sus moléculas pueden escapar a la fase gaseosa mucho más fácilmente y con menos energía (calor).
Por Qué Esto Protege su Muestra
Muchos compuestos químicos, especialmente moléculas orgánicas complejas o materiales biológicos, son térmicamente sensibles.
Aplicar el alto calor necesario para hervir algo como el DMSO (punto de ebullición: 189 °C) a presión atmosférica casi con certeza causaría descomposición, reacciones secundarias o polimerización, destruyendo su producto final. La evaporación a baja presión evita esto por completo.
Métodos Principales para la Evaporación a Baja Presión
Los laboratorios utilizan equipos especializados diseñados para explotar la relación presión-temperatura. Los dos métodos más comunes son la evaporación rotatoria y la liofilización.
El Evaporador Rotatorio ("Rotavap")
Un evaporador rotatorio es el caballo de batalla más común para esta tarea. Elimina disolventes de manera eficiente al combinar tres acciones simultáneamente.
- Presión Reducida: Una bomba de vacío reduce la presión dentro del sistema.
- Calentamiento Suave: Un baño de agua proporciona un nivel controlado y bajo de calor al matraz.
- Rotación: Hacer girar el matraz extiende la muestra en una película delgada, lo que aumenta drásticamente el área de superficie para una evaporación más rápida y evita el hervor violento (bumping).
Este método es ideal para eliminar disolventes orgánicos comunes de alto punto de ebullición como DMSO, DMF y NMP.
Liofilización (Secado por Congelación)
Para las muestras más sensibles, especialmente aquellas en agua, la liofilización es el estándar de oro. Este proceso omite por completo la fase líquida.
Primero, la muestra se congela hasta quedar sólida. Luego, se aplica un vacío muy profundo. Bajo estas condiciones, el disolvente congelado sublima —pasando directamente de sólido a gas—, que luego es capturado por un condensador extremadamente frío.
Esta técnica es esencial para preservar la estructura de materiales delicados como proteínas, péptidos y nanopartículas que se dañarían por cualquier cantidad de calor o el estrés físico de la evaporación convencional.
Errores Comunes a Evitar
Aunque son potentes, estas técnicas requieren una ejecución adecuada para ser efectivas y seguras. Comprender los problemas potenciales es fundamental para el éxito.
El Riesgo de "Bumping" (Ebullición Explosiva)
Bajo vacío, un líquido a veces puede sobrecalentarse y hervir explosivamente en un fenómeno llamado bumping. Esto puede hacer que pierda una porción significativa de su muestra hacia el condensador.
La rotación de un rotavap es la principal defensa contra el bumping. Para sistemas de vacío estáticos, añadir una barra magnética puede ayudar.
Elegir el Nivel de Vacío Correcto
Más vacío no siempre es mejor. Si la presión es demasiado baja, puede congelar accidentalmente su disolvente en el matraz (un problema común con el agua en un rotavap), lo que ralentiza drásticamente la evaporación.
Siempre consulte una tabla de presión de vapor o un nomograma para su disolvente específico para encontrar la configuración óptima de temperatura y presión.
La Trampa Fría es Innegociable
Una trampa fría —un condensador enfriado con hielo seco/acetona o nitrógeno líquido— siempre debe colocarse entre su aparato y la bomba de vacío.
Los vapores de disolvente son altamente corrosivos y destruirán el aceite y los componentes internos de una bomba sin protección. La trampa fría condensa estos vapores en un líquido o sólido, ahorrándole una reparación muy costosa.
Selección de la Técnica Correcta para su Disolvente
Su elección de método depende totalmente del disolvente que está eliminando y de la sensibilidad de su compuesto.
- Si su disolvente es DMSO, DMF o NMP: Un evaporador rotatorio conectado a una bomba de vacío adecuada y protegido por una trampa fría es el método estándar de la industria.
- Si su disolvente es agua y su muestra es altamente sensible al calor (p. ej., una proteína): La liofilización (secado por congelación) es la opción superior para preservar su delicada estructura.
- Si está eliminando cantidades finales y traza de disolvente de un sólido estable: Se puede utilizar un colector de alto vacío (línea Schlenk) o un horno de vacío para el paso final de secado después de la eliminación a granel.
Dominar el control de la presión es la clave para aislar eficientemente su compuesto puro sin compromisos.
Tabla Resumen:
| Método | Mejor para Disolventes | Beneficio Clave |
|---|---|---|
| Evaporación Rotatoria | DMSO, DMF, NMP | Eliminación rápida y eficiente con calentamiento suave |
| Liofilización | Agua (para muestras sensibles) | Preserva estructuras delicadas como las proteínas |
| Colector de Alto Vacío | Eliminación de trazas de disolvente | Paso de secado final para sólidos estables |
¿Tiene problemas con disolventes de alto punto de ebullición? KINTEK se especializa en equipos y consumibles de laboratorio, proporcionando evaporadores rotatorios, bombas de vacío y trampas frías confiables para garantizar que sus muestras sensibles estén protegidas durante la evaporación. Nuestra experiencia ayuda a laboratorios como el suyo a obtener compuestos puros y sin daños de manera eficiente. ¡Póngase en contacto con nuestros expertos hoy para encontrar la solución de evaporación perfecta para sus necesidades!
Guía Visual
Productos relacionados
- Bomba de Vacío de Agua Circulante para Uso de Laboratorio e Industrial
- Bomba de vacío de paletas rotativas de laboratorio para uso en laboratorio
- Bomba de vacío de diafragma sin aceite para uso en laboratorio e industrial
- Prensa Térmica Hidráulica Eléctrica Calefactada al Vacío para Laboratorio
- Máquina de Montaje en Frío al Vacío para Preparación de Muestras
La gente también pregunta
- ¿Cuál es el propósito de la cámara de compresión en una bomba de vacío? El corazón de la generación de vacío
- ¿Cómo afecta la rotación del impulsor al flujo de gas en una bomba de vacío de circulación de agua? Una guía del principio del anillo líquido
- ¿Qué determina el grado de vacío alcanzable por una bomba de vacío de circulación de agua? Descubre la física de sus límites
- ¿Cuáles son las ventajas de una bomba de vacío de circulación de agua? Durabilidad superior para entornos de laboratorio exigentes
- ¿Qué tipos de gases puede manejar una bomba de vacío de circulación de agua? Maneje de forma segura gases inflamables, condensables y sucios



















