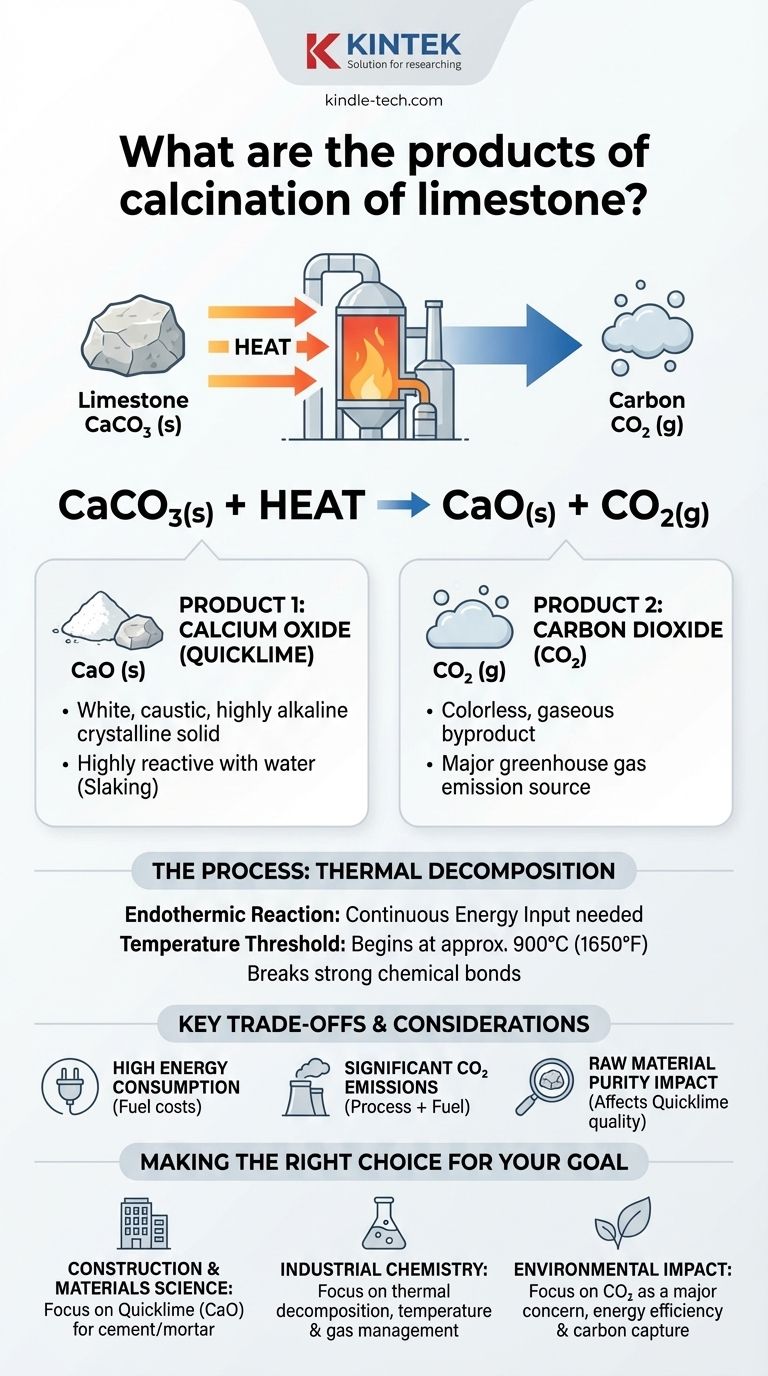
En resumen, la calcinación de la piedra caliza produce dos productos clave: óxido de calcio (CaO) y dióxido de carbono (CO₂). Este proceso implica calentar la piedra caliza, que es principalmente carbonato de calcio (CaCO₃), a una temperatura alta, lo que provoca su descomposición química en lugar de simplemente fundirse o quemarse.
La calcinación de la piedra caliza es un proceso industrial fundamental. Es una reacción de descomposición térmica que transforma una roca natural estable en un bloque de construcción químico altamente reactivo (óxido de calcio) al liberar dióxido de carbono gaseoso.

La Química de la Calcinación: Una Mirada Más Cercana
Para comprender completamente el proceso, es esencial comprender la transformación química subyacente y las condiciones necesarias para que ocurra.
La Ecuación Química Central
La reacción es elegantemente simple y es una piedra angular de la química inorgánica. Es una reacción endotérmica, lo que significa que requiere una entrada continua de energía (calor) para proceder.
La ecuación balanceada es: CaCO₃(s) + Calor → CaO(s) + CO₂(g)
Esto muestra que una molécula de carbonato de calcio sólido se descompone en una molécula de óxido de calcio sólido y una molécula de dióxido de carbono gaseoso.
El Papel de la Descomposición Térmica
La calcinación no es una reacción con calor; es una descomposición causada por el calor. La energía térmica se utiliza para romper los fuertes enlaces químicos dentro de la estructura del carbonato de calcio.
Umbral de Temperatura Crítico
La descomposición del carbonato de calcio comienza a aproximadamente 900°C (1650°F) bajo presión atmosférica normal. En los hornos industriales, las temperaturas a menudo se mantienen más altas para asegurar que la reacción proceda de manera eficiente y completa.
Comprender los Productos y sus Propiedades
Los dos productos de esta reacción tienen características y usos muy diferentes, razón por la cual el proceso es tan fundamental para la industria.
Producto 1: Óxido de Calcio (Cal Viva)
El óxido de calcio, comúnmente conocido como cal viva o cal quemada, es el producto principal deseado. Es un sólido cristalino blanco, cáustico y altamente alcalino.
Su propiedad más importante es su alta reactividad, especialmente con el agua. Esta reacción exotérmica, llamada apagado, produce hidróxido de calcio o cal hidratada.
Producto 2: Dióxido de Carbono (CO₂)
El dióxido de carbono es el subproducto gaseoso que se libera y se elimina del horno durante el proceso.
Aunque a veces se captura para otros usos industriales, más a menudo se considera un producto de desecho y una fuente significativa de emisiones de gases de efecto invernadero.
Comprender las Compensaciones y Consideraciones Clave
Si bien el proceso es sencillo químicamente, su aplicación industrial implica desafíos e impactos significativos que deben gestionarse.
Alto Consumo de Energía
Alcanzar y mantener temperaturas superiores a 900°C es un proceso extremadamente intensivo en energía. Los costos de combustible representan una gran parte del gasto operativo de la producción de cal viva.
Emisiones Significativas de CO₂
La calcinación de la piedra caliza es una fuente importante a nivel mundial de emisiones de dióxido de carbono. El CO₂ proviene de dos fuentes: la descomposición química de la piedra caliza en sí y los combustibles fósiles que se queman típicamente para calentar los hornos.
Impacto de la Pureza de la Materia Prima
La calidad de la cal viva final depende directamente de la pureza de la piedra caliza inicial. Impurezas como la sílice, la arcilla o el carbonato de magnesio pueden afectar la reactividad y las propiedades del producto final, lo cual es fundamental para aplicaciones como la fabricación de acero y cemento.
Tomar la Decisión Correcta para su Objetivo
Comprender este proceso le permite apreciar su papel en diferentes campos. La importancia de los productos depende totalmente de su aplicación específica.
- Si su enfoque principal es la construcción y la ciencia de los materiales: El producto clave es el óxido de calcio (cal viva), ya que es el precursor esencial del cemento y la argamasa.
- Si su enfoque principal es la química industrial: Considere esto como una reacción de descomposición térmica clásica donde la gestión de la temperatura, las entradas de energía y la eliminación de gases son las variables críticas del proceso.
- Si su enfoque principal es el impacto ambiental: Reconozca que el subproducto, el dióxido de carbono, es una preocupación importante, lo que hace que la eficiencia energética y las tecnologías de captura de carbono sean vitales para el futuro de la industria.
En última instancia, comprender los productos de la calcinación de la piedra caliza es el primer paso para dominar su aplicación en innumerables industrias esenciales.
Tabla Resumen:
| Producto | Fórmula Química | Nombre Común | Propiedades Clave |
|---|---|---|---|
| Óxido de Calcio | CaO | Cal Viva | Blanco, cáustico, altamente alcalino, reactivo con el agua |
| Dióxido de Carbono | CO₂ | - | Gas incoloro, gas de efecto invernadero, subproducto industrial |
Optimice su proceso de calcinación con el equipo de laboratorio avanzado de KINTEK. Ya sea que esté investigando reacciones de descomposición térmica o escalando la producción industrial, nuestros hornos y calcinadores de alta temperatura garantizan un control preciso de la temperatura y eficiencia energética. Le proporcionamos las herramientas confiables que necesita para producir cal viva de alta pureza mientras gestiona el consumo de energía y las emisiones. Contáctenos hoy (#ContactForm) para discutir cómo nuestras soluciones pueden mejorar sus flujos de trabajo de ciencia de materiales y química industrial.
Guía Visual
Productos relacionados
- Planta de Horno de Pirólisis de Horno Rotatorio Eléctrico Máquina Calcinadora Horno Rotatorio Pequeño Horno Giratorio
- Horno Rotatorio Eléctrico de Trabajo Continuo, Pequeña Planta de Pirólisis con Calefacción de Horno Rotatorio
- Horno Rotatorio Eléctrico Pequeño Horno Rotatorio para Regeneración de Carbón Activado
- Horno de Tubo Rotatorio Continuo Sellado al Vacío Horno de Tubo Giratorio
- Mezclador Rotatorio de Disco de Laboratorio para Mezcla y Homogeneización Eficiente de Muestras
La gente también pregunta
- ¿Cuál es el material refractario de un horno rotatorio? Elija el revestimiento adecuado para la eficiencia y durabilidad
- ¿Qué es la regeneración de carbono? Restaure su carbón activado agotado para su reutilización
- ¿Cuáles son las fuentes de calentamiento para la pirólisis? Métodos directos versus indirectos para el rendimiento óptimo del producto
- ¿Cuál es la zona de temperatura en un horno rotatorio? Domine el perfil térmico para un procesamiento óptimo
- ¿Para qué se utiliza un horno rotatorio? Dominando el procesamiento uniforme a alta temperatura
- ¿Cuál es la diferencia entre la gasificación y la pirólisis de biocarbón? Descubra el proceso térmico adecuado para su biomasa
- ¿Cuál es la diferencia entre la pirólisis por microondas y la pirólisis convencional? Elija el método de calentamiento adecuado para su proceso
- ¿Cuál es la temperatura de un horno rotatorio? Depende de su material y objetivo de proceso



















