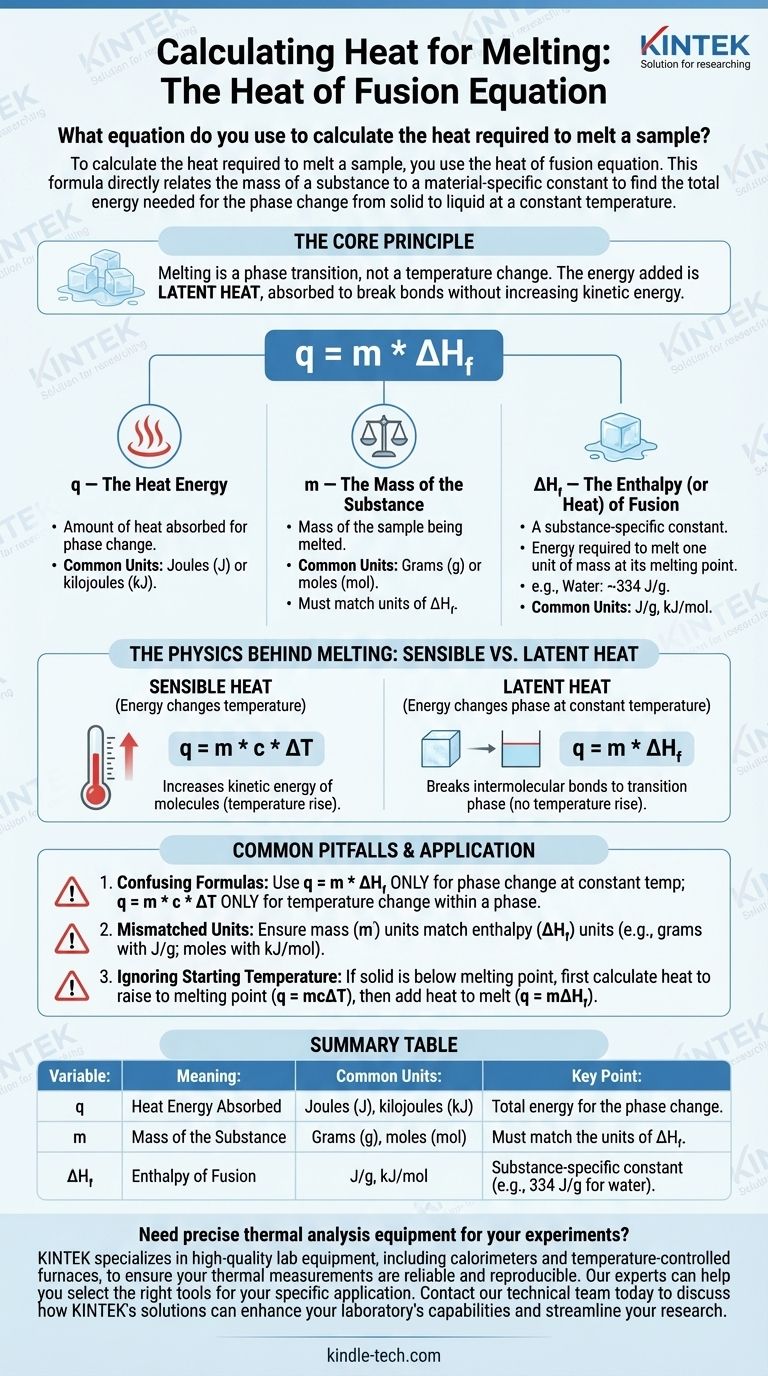
Para calcular el calor requerido para fundir una muestra, se utiliza la ecuación del calor de fusión. Esta fórmula relaciona directamente la masa de una sustancia con una constante específica del material para encontrar la energía total necesaria para el cambio de fase de sólido a líquido a una temperatura constante.
El principio central es que la fusión es una transición de fase, no un cambio de temperatura. La energía que se añade se denomina calor latente, que se absorbe para romper los enlaces de la estructura sólida sin aumentar la energía cinética de las moléculas.

Desglose de la Ecuación del Calor de Fusión
La fórmula para calcular el calor absorbido durante la fusión es:
q = m \cdot \Delta H_f
Cada variable en esta ecuación representa una pieza crítica del proceso físico. Entenderlas individualmente es clave para aplicar la fórmula correctamente.
q — La Energía Calorífica
q representa la cantidad de calor absorbido por la sustancia para experimentar el cambio de fase. Este valor se expresa típicamente en Julios (J) o kilojulios (kJ), aunque contextos más antiguos pueden usar calorías (cal).
m — La Masa de la Sustancia
m es la masa de la muestra que se está fundiendo. Es crucial que las unidades de masa, típicamente gramos (g) o moles (mol), coincidan con las unidades utilizadas en la constante de calor de fusión para esa sustancia.
\Delta H_f — La Entalpía (o Calor) de Fusión
\Delta H_f es la variable más importante. Es la entalpía de fusión, a menudo denominada calor latente de fusión.
Esta es una constante física única para cada sustancia. Define la cantidad de energía requerida para fundir una unidad de masa (por ejemplo, 1 gramo o 1 mol) de esa sustancia a su punto de fusión.
Por ejemplo, el calor de fusión del agua es aproximadamente 334 Julios por gramo (J/g). Esto significa que se deben añadir 334 Julios de energía para fundir 1 gramo de hielo a 0°C en 1 gramo de agua líquida a 0°C.
La Física Detrás de la Fusión: Calor Sensible vs. Calor Latente
Un punto común de confusión es por qué la temperatura no aumenta durante la fusión. Esto se explica por la diferencia entre dos tipos de energía calorífica.
Calor Sensible
El calor sensible es la energía que cambia la temperatura de una sustancia. Cuando se añade calor sensible, se aumenta la energía cinética de las moléculas, haciendo que se muevan más rápido, lo que medimos como un aumento de temperatura. La fórmula para esto es q = m \cdot c \cdot \Delta T.
Calor Latente
El calor latente es la energía absorbida o liberada durante un cambio de fase a temperatura constante. Durante la fusión, la energía entrante se utiliza completamente para romper los enlaces intermoleculares que mantienen unida la red cristalina del sólido, haciendo la transición a un líquido.
Debido a que la energía está "oculta" en el cambio de fase en lugar de causar un aumento de temperatura, se denomina latente.
Errores Comunes a Evitar
Aplicar el concepto o la fórmula incorrecta es una fuente frecuente de error en los cálculos termodinámicos. Tenga en cuenta estos errores comunes.
Confundir Calor de Fusión con Calor Específico
El error más común es usar la fórmula equivocada.
- Use
q = m \cdot \Delta H_f(Calor de Fusión) SOLO para un cambio de fase a temperatura constante (por ejemplo, fundir hielo a 0°C). - Use
q = m \cdot c \cdot \Delta T(Calor Específico) SOLO para cambiar la temperatura de una sustancia dentro de una sola fase (por ejemplo, calentar hielo sólido de -10°C a 0°C).
Unidades Desiguales
Siempre verifique sus unidades. Si su masa (m) está en gramos, su calor de fusión (\Delta H_f) debe estar en Julios por gramo (J/g). Si \Delta H_f se da en kilojulios por mol (kJ/mol), primero debe convertir la masa de su muestra a moles.
Ignorar la Temperatura Inicial
La ecuación del calor de fusión solo se aplica si la sustancia ya está en su punto de fusión. Si tiene un sólido por debajo de su punto de fusión, debe realizar un cálculo de dos pasos:
- Calcular el calor necesario para elevar el sólido a su punto de fusión (
q = mc\Delta T). - Calcular el calor necesario para fundir el sólido en su punto de fusión (
q = m\Delta H_f). - Sumar los resultados para obtener el calor total requerido.
Aplicando la Fórmula Correcta para su Cálculo
Para asegurarse de resolver su problema correctamente, identifique el proceso exacto que necesita calcular.
- Si su enfoque principal es fundir una sustancia que ya está en su punto de fusión: Solo necesita la ecuación del calor de fusión:
q = m \cdot \Delta H_f. - Si su enfoque principal es calentar una sustancia sin cambiar su fase: Solo necesita la ecuación de capacidad calorífica específica:
q = m \cdot c \cdot \Delta T. - Si su enfoque principal es calentar un sólido y luego fundirlo por completo: Debe calcular el calor para ambos pasos por separado y sumarlos:
q_{total} = (m \cdot c \cdot \Delta T)_{calentamiento} + (m \cdot \Delta H_f)_{fusión}.
Comprender qué proceso físico está modelando es la clave para seleccionar la ecuación correcta.
Tabla de Resumen:
| Variable | Significado | Unidades Comunes | Punto Clave |
|---|---|---|---|
| q | Energía Calorífica Absorbida | Julios (J), kilojulios (kJ) | Energía total para el cambio de fase |
| m | Masa de la Sustancia | Gramos (g), moles (mol) | Debe coincidir con las unidades de $\Delta H_f$ |
| $\Delta H_f$ | Entalpía de Fusión | J/g, kJ/mol | Constante específica de la sustancia (ejemplo: 334 J/g para el agua) |
¿Necesita equipos de análisis térmico precisos para sus experimentos?
Calcular con precisión los requisitos de calor es fundamental en la ciencia de los materiales, la química y la farmacéutica. KINTEK se especializa en equipos de laboratorio de alta calidad, incluidos calorímetros y hornos con temperatura controlada, para garantizar que sus mediciones térmicas sean fiables y reproducibles.
Nuestros expertos pueden ayudarle a seleccionar las herramientas adecuadas para su aplicación específica, ya sea que esté estudiando cambios de fase, síntesis de materiales o cinética de reacciones.
Póngase en contacto con nuestro equipo técnico hoy mismo para analizar cómo las soluciones de KINTEK pueden mejorar las capacidades de su laboratorio y agilizar su investigación.
Guía Visual
Productos relacionados
- Máquina de prensa hidráulica calentada con placas calentadas manuales integradas para uso en laboratorio
- Máquina de prensa hidráulica con placas calefactoras de 24T, 30T, 60T para prensa en caliente de laboratorio
- Molde de prensa eléctrica de calentamiento cilíndrico de laboratorio para aplicaciones de laboratorio
- Máquina de prensa hidráulica automática con calefacción y placas calientes para prensa caliente de laboratorio 25T 30T 50T
- Molde de Prensa Infrarroja de Laboratorio
La gente también pregunta
- ¿Cuáles son las principales consideraciones técnicas para usar tapones de lana de cuarzo? Optimice su celda de reacción espectroscópica
- ¿Qué características incluye el sistema de alarma en los congeladores ULT? Proteja sus muestras con seguridad multicapa
- ¿Cuáles son las diferentes técnicas de deposición? Una guía sobre PVD, CVD, ALD y más
- ¿Cuáles son las ventajas de la prensa de filtros? Logre la máxima deshidratación y una claridad de filtrado superior
- ¿Cuál es la temperatura recomendada para almacenar proteínas? Asegure la estabilidad y actividad a largo plazo
- ¿Cuál es la diferencia entre pirólisis flash y pirólisis rápida? Una guía sobre la velocidad de reacción y la producción de productos
- ¿Cuál es el propósito del recubrimiento por pulverización catódica? Lograr precisión y uniformidad a escala atómica
- ¿Qué es un circuito de película delgada? Logre una miniaturización y un rendimiento de alta frecuencia inigualables


























