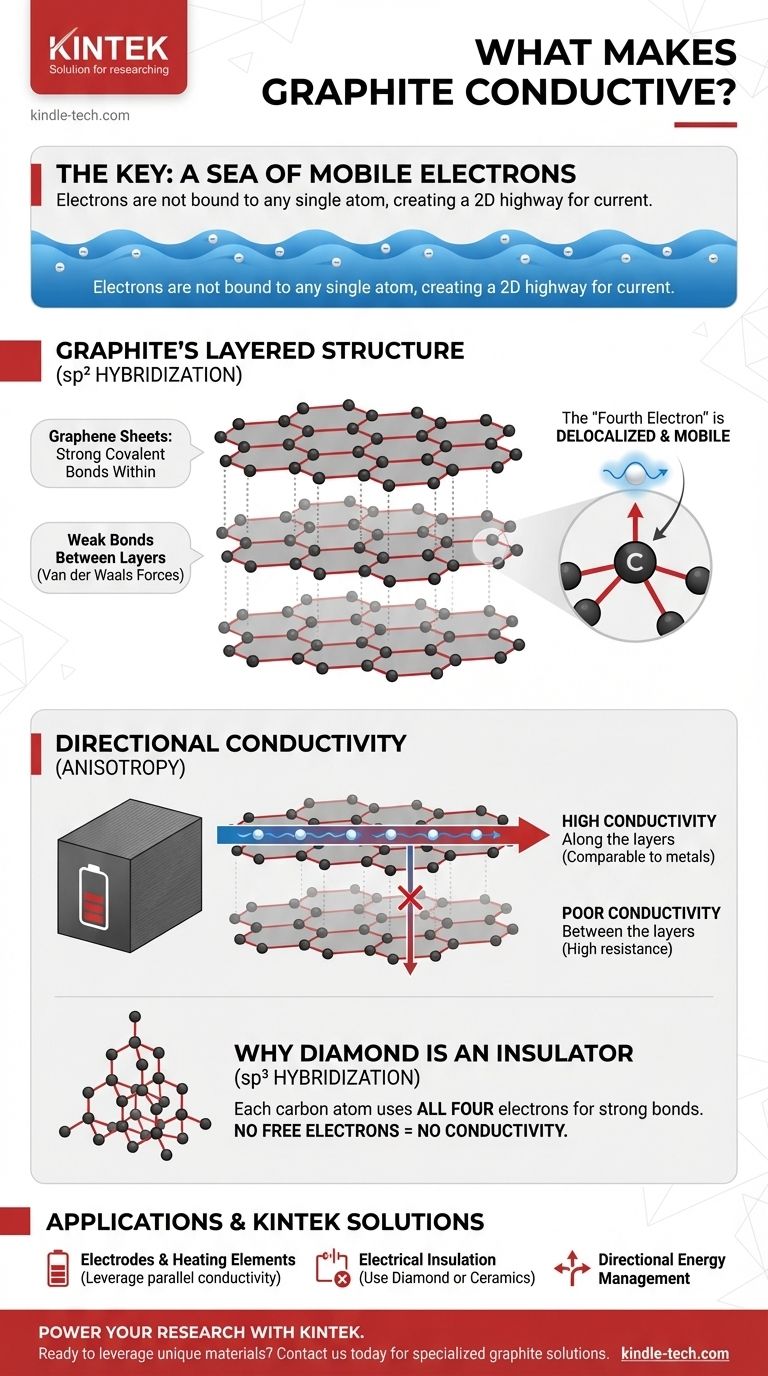
En esencia, la conductividad eléctrica en el grafito es causada por un mar de electrones móviles que no están ligados a ningún átomo individual. Este comportamiento electrónico único es un resultado directo de la estructura atómica en capas específica del grafito y la forma en que sus átomos de carbono se unen.
La idea crucial es que, mientras que la mayoría de los no metales fijan sus electrones en su lugar, la estructura única en forma de lámina del grafito deja un electrón por átomo libre para moverse. Este electrón "deslocalizado" crea una autopista electrónica 2D, lo que permite que el grafito conduzca la electricidad de manera muy similar a un metal.

La base: La estructura en capas del grafito
Para comprender el flujo de electricidad, primero debemos visualizar la forma física del material. El grafito no es un conjunto aleatorio de átomos; es un cristal altamente organizado.
Una pila de láminas de grafeno
El grafito se compone de innumerables capas de átomos de carbono. Cada capa individual, conocida como lámina de grafeno, es un plano plano y bidimensional.
Enlaces fuertes en el interior, enlaces débiles en el medio
Dentro de cada lámina, los átomos de carbono están dispuestos en un patrón de panal hexagonal, conectados por enlaces covalentes extremadamente fuertes. Sin embargo, los enlaces que mantienen unidas las láminas separadas son muy débiles (fuerzas de van der Waals).
El papel del electrón: Desbloqueando la conductividad
La naturaleza específica de los enlaces dentro de las láminas de grafeno es la verdadera fuente de la conductividad del grafito.
El enlace de hibridación sp²
Cada átomo de carbono tiene cuatro electrones de capa externa disponibles para la unión. En el grafito, cada átomo utiliza tres de estos electrones para formar enlaces fuertes y planos con sus tres vecinos en la lámina hexagonal.
El "cuarto electrón" crea un mar de movilidad
Esto deja un electrón por átomo de carbono que no participa en el marco de enlace principal. Este electrón ocupa un tipo diferente de orbital (orbital p) y ya no está atado a su átomo original.
En cambio, estos "cuartos electrones" de todos los átomos de una lámina se fusionan para formar un mar deslocalizado de electrones. Estos electrones son libres de moverse por toda la superficie bidimensional de su lámina de grafeno.
Cómo los electrones móviles permiten la corriente
La corriente eléctrica es simplemente el flujo de carga. Cuando se aplica un voltaje a través de un trozo de grafito, esta gran reserva de electrones móviles es empujada fácilmente a lo largo de las láminas de grafeno, creando una potente corriente eléctrica.
Comprender las compensaciones: Conductividad direccional
La conductividad del grafito no es uniforme en todas las direcciones. Esta propiedad, conocida como anisotropía, es una consideración crítica en cualquier aplicación práctica.
Alta conductividad a lo largo de las capas
La electricidad fluye excepcionalmente bien en paralelo a las láminas de grafeno. El mar de electrones deslocalizados proporciona un camino casi sin obstáculos para la corriente, haciendo que la conductividad del grafito en esta dirección sea comparable a la de muchos metales.
Poca conductividad entre las capas
En contraste, es muy difícil para los electrones saltar de una lámina a otra. El gran espacio y las fuerzas débiles entre las capas crean una alta resistencia, lo que convierte al grafito en un mal conductor perpendicular a sus capas.
¿Por qué el diamante no es conductor? Una comparación clave
Para apreciar plenamente la singularidad del grafito, es útil compararlo con el diamante, otra forma de carbono puro.
La unión sp³ en el diamante
En el diamante, cada átomo de carbono utiliza los cuatro electrones de su capa externa para formar fuertes enlaces covalentes con cuatro átomos vecinos en una red tridimensional rígida.
Sin electrones libres, sin conductividad
Debido a que cada electrón está bloqueado en un enlace fijo y localizado, no hay electrones móviles disponibles para transportar una corriente. Esta es la razón por la cual el diamante es uno de los aislantes eléctricos mejor conocidos.
Cómo aplicar esto a su objetivo
Las propiedades únicas de la conductividad del grafito dictan su uso en diversas aplicaciones.
- Si su enfoque principal es crear un electrodo o un elemento calefactor: Aproveche la excelente conductividad del grafito a lo largo de sus planos, orientando el material de modo que la corriente fluya paralela a las láminas de grafeno.
- Si su enfoque principal es el aislamiento eléctrico: El grafito es la opción incorrecta; se requiere un material como el diamante o una cerámica, ya que no tienen electrones libres.
- Si su enfoque principal es la gestión direccional del calor o la electricidad: La naturaleza anisotrópica del grafito es una ventaja, ya que le permite canalizar la energía a lo largo de un eje mientras aísla a lo largo de otro.
En última instancia, el grafito sirve como un ejemplo perfecto de cómo la estructura atómica de un material dicta directamente sus propiedades más fundamentales.
Tabla de resumen:
| Factor clave | Función en la conductividad |
|---|---|
| Hibridación sp² | Crea una red hexagonal 2D, dejando un electrón por átomo deslocalizado. |
| Electrones deslocalizados | Forman un "mar" de portadores de carga móviles que pueden moverse libremente dentro de una lámina de grafeno. |
| Estructura en capas | Permite una alta conductividad a lo largo de las láminas pero una mala conductividad entre ellas (anisotropía). |
| Comparación con el diamante (sp³) | El diamante no tiene electrones libres (todos los electrones están enlazados), lo que lo convierte en un aislante. |
¿Listo para aprovechar las propiedades conductoras únicas del grafito en su laboratorio?
En KINTEK, nos especializamos en equipos y consumibles de laboratorio de alta calidad. Ya sea que necesite grafito para electrodos, elementos calefactores o aplicaciones especializadas, nuestros materiales están diseñados para proporcionar un rendimiento superior y una conductividad direccional.
Contáctenos hoy para discutir cómo nuestras soluciones pueden impulsar su investigación e innovación. Permita que nuestros expertos le ayuden a seleccionar los materiales perfectos para sus necesidades específicas de laboratorio.
Póngase en contacto con nuestro equipo ahora →
Guía Visual
Productos relacionados
- Horno Vertical de Vacío de Grafito de Alta Temperatura para Grafización
- Horno Continuo de Grafización al Vacío de Grafito
- Horno de grafización al vacío a ultra alta temperatura de grafito
- Horno de Grafización de Película de Alta Conductividad Térmica de Vacío de Grafito
- Horno de Tubo de Laboratorio de Alta Temperatura de 1400℃ con Tubo de Alúmina
La gente también pregunta
- ¿Es bueno el grafito para altas temperaturas? Desbloquee todo su potencial en atmósferas controladas
- ¿Cuáles son las desventajas de usar grafito? Limitaciones clave en aplicaciones de alta tecnología
- ¿El grafito se ve afectado por el calor? Descubra su notable resistencia y estabilidad a altas temperaturas
- ¿Por qué el grafito no se derrite? Descubriendo los secretos de su extrema resistencia al calor
- ¿Cuál es la resistencia a la temperatura del grafito? Desbloqueando su potencial de alta temperatura en su laboratorio



















