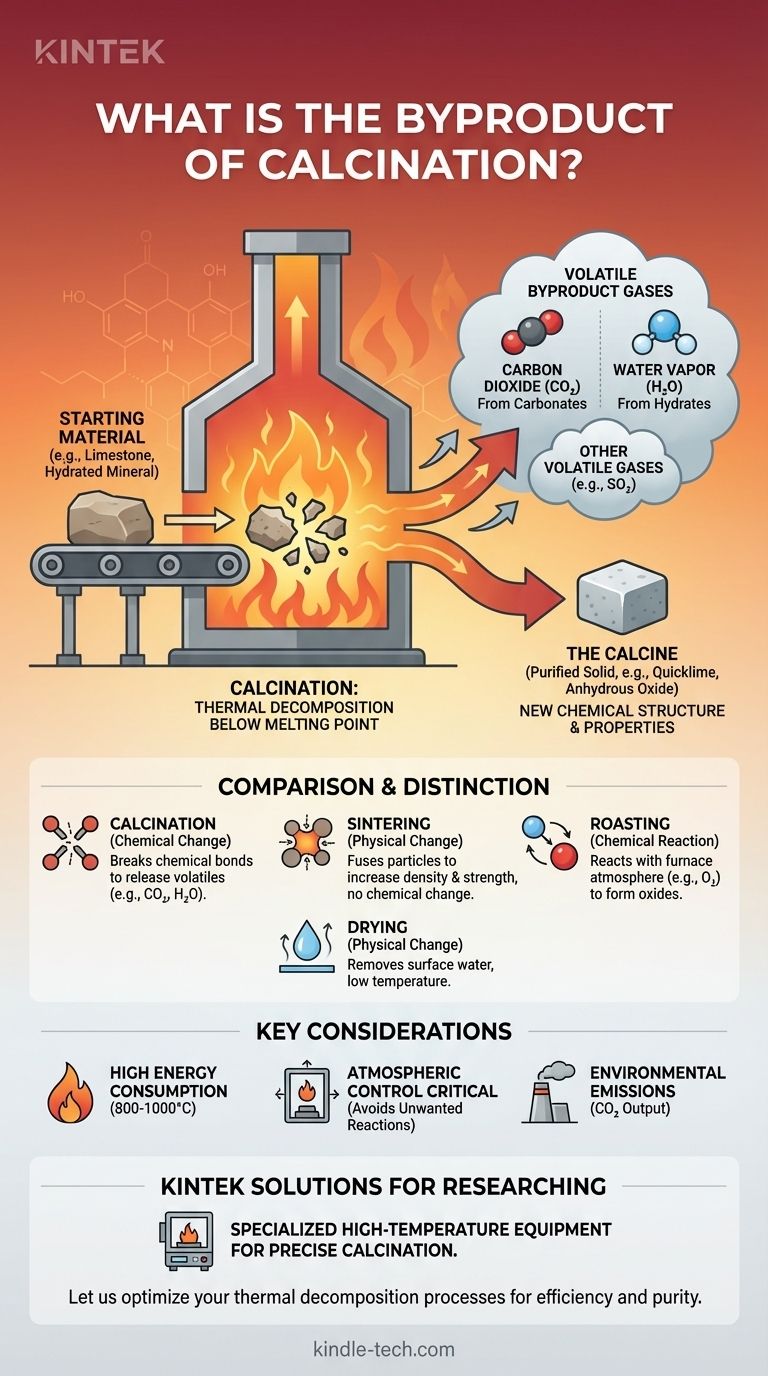
En casi todos los casos, el subproducto principal de la calcinación es un gas. Lo más común es el dióxido de carbono (CO2) al calentar carbonatos como la piedra caliza, o vapor de agua (H2O) al calentar minerales hidratados. El proceso es una forma de descomposición térmica, donde el calor intenso descompone un compuesto en un sólido purificado y gases volátiles que se desprenden.
La calcinación es un proceso de transformación química, no simplemente de purificación. Utiliza calor intenso por debajo del punto de fusión para descomponer un material, cambiando fundamentalmente su estructura química al desprender subproductos volátiles como dióxido de carbono o vapor de agua.

¿Qué es la calcinación? Una mirada más profunda
La calcinación es un proceso fundamental en la metalurgia y la ciencia de los materiales, particularmente en la producción de cemento, cal y el refinado de ciertos minerales. Comprender el mecanismo es clave para entender su propósito.
El principio fundamental: la descomposición térmica
En esencia, la calcinación consiste en romper enlaces químicos con calor. La energía aplicada hace que el material inicial se descomponga en dos o más sustancias nuevas.
Una de estas sustancias es el producto sólido deseado, a menudo llamado "calcina". Las otras sustancias son los subproductos gaseosos que se eliminan.
Subproductos comunes explicados
El subproducto específico depende completamente de la composición química del material que se calienta.
- Dióxido de carbono (CO2): Este es el ejemplo más famoso. Cuando el carbonato de calcio (CaCO3, piedra caliza) se calcina, se descompone en óxido de calcio (CaO, cal viva) y libera gas CO2. Esta es la reacción central en la fabricación de cemento.
- Vapor de agua (H2O): Muchos minerales existen como hidratos, lo que significa que tienen moléculas de agua encerradas en su estructura cristalina. La calcinación de la bauxita (mineral de aluminio) o el yeso elimina esta agua químicamente ligada en forma de vapor.
- Otros gases volátiles: En aplicaciones más específicas, se pueden liberar otros gases. Por ejemplo, calentar ciertos sulfatos puede liberar dióxido de azufre (SO2), aunque este proceso a menudo se superpone con una técnica relacionada llamada tostación.
El producto deseado: la calcina
El material sólido que queda después de que los subproductos volátiles se han desprendido es el objetivo principal. Esta calcina resultante ahora tiene diferentes propiedades químicas y físicas.
Por ejemplo, la cal viva producida a partir de la calcinación de la piedra caliza es altamente reactiva, lo cual es esencial para la fabricación de cemento y otros productos químicos industriales.
Cómo se diferencia la calcinación de otros tratamientos térmicos
El término "calcinación" a menudo se confunde con otros procesos de alta temperatura. La distinción radica en el objetivo químico o físico subyacente.
Calcinación vs. Sinterización
La calcinación cambia la composición química de un material. Descompone un compuesto en otro eliminando componentes volátiles.
La sinterización, como señala correctamente la referencia, cambia la forma física de un material. Utiliza calor para fusionar pequeñas partículas en una pieza sólida única sin fundirlas, aumentando su resistencia y densidad. La composición química permanece inalterada.
Calcinación vs. Tostación
Este es un punto de confusión muy común. La calcinación se realiza típicamente en una atmósfera controlada o inerte para provocar la descomposición.
La tostación, por el contrario, es un proceso que implica una reacción química con la atmósfera del horno, específicamente con oxígeno. Es una forma de oxidación, a menudo utilizada para convertir minerales de sulfuro metálico en óxidos metálicos.
Calcinación vs. Secado
El secado es un proceso de baja temperatura que elimina el agua físicamente absorbida de la superficie de una sustancia.
La calcinación es un proceso de alta temperatura que elimina el agua químicamente ligada u otros compuestos volátiles del interior de la estructura cristalina del material, lo que requiere mucha más energía para romper esos enlaces químicos.
Comprendiendo los inconvenientes y el contexto
Aunque potente, la calcinación es un proceso industrial con importantes consideraciones operativas que deben gestionarse.
Alto consumo de energía
Alcanzar y mantener las altas temperaturas necesarias para romper los enlaces químicos (a menudo 800-1000°C o más) hace que la calcinación sea un proceso extremadamente intensivo en energía y costoso.
El control atmosférico es crucial
La composición del gas dentro del horno es crítica. Pueden ocurrir reacciones no deseadas, como la oxidación por exceso de aire, si la atmósfera no se controla cuidadosamente, lo que lleva a un producto final impuro.
Emisiones ambientales
Los subproductos gaseosos son una salida principal. La calcinación de piedra caliza para la producción de cemento es una de las mayores fuentes industriales individuales de emisiones globales de CO2, un factor crítico en la gestión y regulación ambiental.
Tomando la decisión correcta para su objetivo
Comprender la calcinación le permite reconocer su papel específico en la creación de los materiales que dan forma a nuestro mundo.
- Si su enfoque principal es producir cemento o cal: La calcinación es el proceso central utilizado para descomponer la piedra caliza (CaCO3) en cal viva reactiva (CaO) al desprender CO2.
- Si su enfoque principal es preparar un catalizador o adsorbente: La calcinación se utiliza para eliminar agua y precursores volátiles, creando un material puro de alta superficie listo para su uso.
- Si su enfoque principal es fortalecer una pieza de cerámica o polvo metálico: Está pensando en la sinterización, que compacta partículas para aumentar la densidad, no en la calcinación que cambia su química.
En última instancia, la calcinación es una herramienta fundamental para alterar químicamente un material sólido utilizando calor para liberar sus componentes volátiles.
Tabla resumen:
| Material de calcinación | Gas subproducto común | Producto sólido primario |
|---|---|---|
| Piedra caliza (CaCO₃) | Dióxido de carbono (CO₂) | Cal viva (CaO) |
| Minerales hidratados (p. ej., bauxita, yeso) | Vapor de agua (H₂O) | Óxido anhidro |
| Ciertos sulfatos | Dióxido de azufre (SO₂) | Óxido metálico |
¿Necesita un procesamiento térmico preciso para sus materiales?
La calcinación es un paso crítico en la producción de todo, desde cemento hasta catalizadores. KINTEK se especializa en equipos de laboratorio de alta temperatura, incluidos hornos ideales para procesos de calcinación controlados. Nuestras soluciones le ayudan a lograr las transformaciones químicas exactas que necesita, con un enfoque en la eficiencia y la pureza.
Ya sea que esté desarrollando nuevos materiales, refinando minerales o preparando catalizadores, la experiencia de KINTEK en equipos de laboratorio puede respaldar su I+D y control de calidad. Permítanos ayudarle a optimizar sus procesos de descomposición térmica.
Contacte con KINTEK hoy mismo para discutir sus necesidades específicas de calcinación y descubrir el equipo adecuado para su laboratorio.
Guía Visual
Productos relacionados
- Planta de Horno de Pirólisis de Horno Rotatorio Eléctrico Máquina Calcinadora Horno Rotatorio Pequeño Horno Giratorio
- Horno de Tubo Rotatorio Continuo Sellado al Vacío Horno de Tubo Giratorio
- Horno Rotatorio Eléctrico de Trabajo Continuo, Pequeña Planta de Pirólisis con Calefacción de Horno Rotatorio
- Horno Rotatorio Eléctrico Pequeño Horno Rotatorio Planta de Pirólisis de Biomasa
- Horno Rotatorio Eléctrico Pequeño Horno Rotatorio para Regeneración de Carbón Activado
La gente también pregunta
- ¿Cuál es el propósito de la pirólisis? Transformar los residuos en energía y materiales valiosos
- ¿Cuál es la función de un horno rotatorio? Lograr un procesamiento térmico uniforme y continuo
- ¿Qué es un reactor de pirólisis a pequeña escala piloto? Su guía para elegir el diseño de reactor adecuado
- ¿Qué es el método de co-pirólisis? Un enfoque estratégico para la valorización de residuos y la mejora del bio-aceite
- ¿Cuál es la diferencia entre la pirólisis y la gasificación de la biomasa? Elija el proceso adecuado para sus objetivos
- ¿Cuál es la composición del gas de pirólisis de biomasa? Una guía sobre su composición y valor energético
- ¿Cuáles son los diversos tipos de pirólisis? Compare los métodos para optimizar su rendimiento de biocarbón, bio-aceite o syngas.
- ¿Cuál es la función de una máquina de pirólisis? Convertir residuos en combustible, gas y biocarbón



















