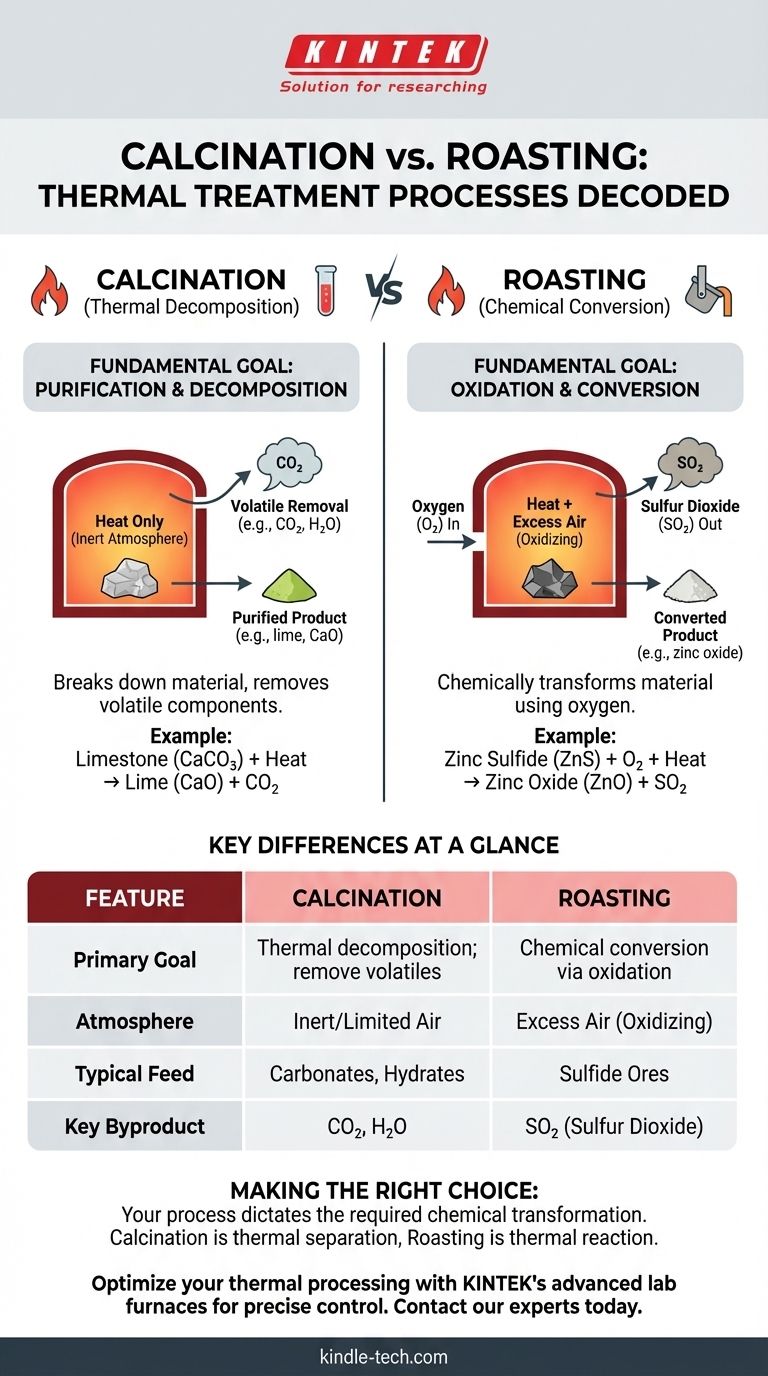
En esencia, la diferencia entre la calcinación y la tostación radica en el papel químico de la atmósfera del horno. La calcinación es un proceso de descomposición térmica que se realiza en ausencia o suministro limitado de aire para eliminar sustancias volátiles. En contraste, la tostación es un proceso de conversión química que se lleva a cabo con un exceso de aire, específicamente para oxidar un material, la mayoría de las veces un mineral de sulfuro metálico.
Piénselo de esta manera: la calcinación utiliza el calor para descomponer una sustancia y eliminar una parte de ella, como expulsar agua de un sólido húmedo. La tostación utiliza el calor y el aire para transformar químicamente toda la sustancia en algo nuevo, como convertir un sulfuro en un óxido.

Deconstruyendo los Procesos: Calcinación
La calcinación es un paso de purificación y descomposición impulsado puramente por el calor. El objetivo es descomponer el material en una forma más estable o deseable eliminando un componente volátil.
El Objetivo Fundamental: Descomposición Térmica
El objetivo principal de la calcinación es inducir la descomposición térmica. Esto significa utilizar altas temperaturas para romper los enlaces químicos y liberar una parte específica del compuesto como gas.
Un ejemplo clásico es la producción de cal (óxido de calcio) a partir de piedra caliza (carbonato de calcio). El calor descompone el carbonato, liberando dióxido de carbono.
CaCO₃ (sólido) + Calor → CaO (sólido) + CO₂ (gas)
El Papel Crítico de la Atmósfera
La calcinación se define por su atmósfera, que es inerte o tiene un suministro de aire (oxígeno) muy limitado. Esto es crucial porque el objetivo es prevenir la oxidación u otras reacciones no deseadas con el entorno del horno.
El proceso se centra únicamente en lo que el calor puede hacerle al material en sí.
Aplicaciones Comunes de la Calcinación
Encontrará la calcinación al preparar materias primas. Sus usos incluyen la eliminación de agua de hidratos (como en el procesamiento de bauxita), la eliminación de dióxido de carbono de los carbonatos o la expulsión de materia orgánica volátil de diversas sustancias.
Deconstruyendo los Procesos: Tostación
La tostación es un proceso metalúrgico diseñado para alterar químicamente los minerales metálicos para hacerlos más fáciles para los pasos subsiguientes, como la fundición. Es fundamentalmente una reacción con oxígeno.
El Objetivo Fundamental: Conversión Química a través de la Oxidación
El objetivo de la tostación es la oxidación. El proceso hace reaccionar intencionalmente el material de alimentación, generalmente un mineral de sulfuro metálico, con oxígeno del aire.
Esto convierte el sulfuro metálico en un óxido metálico, que es más fácil de reducir a metal puro en una etapa posterior.
2ZnS (sólido) + 3O₂ (gas) + Calor → 2ZnO (sólido) + 2SO₂ (gas)
El Papel Crítico de la Atmósfera
La tostación requiere una atmósfera oxidante, lo que significa que se suministra un exceso de aire u oxígeno al horno. El oxígeno no es solo el entorno; es un reactivo principal en el proceso.
Sin suficiente oxígeno, no puede ocurrir la conversión química prevista de sulfuro a óxido.
Aplicaciones Comunes de la Tostación
La tostación es una piedra angular de la metalurgia extractiva. Es el método principal para preparar minerales de sulfuro de metales como zinc, plomo, cobre y níquel para la fundición.
Diferencias Clave de un Vistazo
La elección entre calcinación y tostación depende de su material de partida y del producto final deseado. Son herramientas distintas para diferentes objetivos químicos.
Propósito
La calcinación tiene como objetivo descomponer un material y expulsar un componente volátil (p. ej., H₂O, CO₂).
La tostación tiene como objetivo convertir químicamente un material a través de la oxidación (p. ej., convertir un sulfuro metálico en un óxido metálico).
Condiciones Atmosféricas
La calcinación ocurre en una atmósfera inerte, reductora o pobre en oxígeno para prevenir la oxidación.
La tostación ocurre en una atmósfera oxidante con un exceso de aire para promover la oxidación.
Materiales de Alimentación
La calcinación se utiliza típicamente en hidratos, carbonatos y materiales con componentes orgánicos volátiles.
La tostación se utiliza predominantemente en minerales de sulfuro.
Subproductos Gaseosos
La calcinación produce principalmente gases no tóxicos como dióxido de carbono (CO₂) y vapor de agua (H₂O).
La tostación produce dióxido de azufre (SO₂), un contaminante significativo que debe capturarse y, a menudo, convertirse en ácido sulfúrico para prevenir daños ambientales.
Tomar la Decisión Correcta para su Objetivo
La selección de su proceso está dictada enteramente por la transformación química que necesita lograr.
- Si su objetivo principal es producir cal a partir de piedra caliza: Debe utilizar la calcinación para expulsar el CO₂ sin ninguna otra reacción.
- Si su objetivo principal es preparar mineral de sulfuro de zinc para la fundición: Debe utilizar la tostación para convertir el sulfuro (ZnS) en óxido de zinc (ZnO).
- Si su objetivo principal es eliminar el agua de hidratación de un mineral: Necesita calcinación para expulsar suavemente el H₂O sin alterar el mineral base.
- Si su objetivo principal es crear una materia prima de óxido a partir de un mineral de sulfuro: La tostación es el primer paso esencial en su diagrama de flujo metalúrgico.
En última instancia, la distinción es simple: la calcinación es una separación térmica, mientras que la tostación es una reacción térmica.
Tabla Resumen:
| Característica | Calcinación | Tostación |
|---|---|---|
| Objetivo Principal | Descomposición térmica; eliminar sustancias volátiles | Conversión química mediante oxidación |
| Atmósfera | Inerte o aire limitado (pobre en oxígeno) | Exceso de aire (oxidante) |
| Material de Alimentación Típico | Carbonatos (p. ej., piedra caliza), hidratos | Minerales de sulfuro (p. ej., sulfuro de zinc) |
| Subproducto Clave | CO₂, H₂O (vapor de agua) | SO₂ (dióxido de azufre) |
¿Listo para optimizar su procesamiento térmico?
Ya sea que su objetivo sea la descomposición térmica precisa o la oxidación controlada, los hornos de laboratorio avanzados de KINTEK proporcionan el control atmosférico exacto y la uniformidad de temperatura que necesita. Nuestro equipo está diseñado para la fiabilidad y la precisión en aplicaciones exigentes como la purificación de materiales y la metalurgia extractiva.
Deje que KINTEK sea su socio en el laboratorio. Nos especializamos en equipos duraderos y de alto rendimiento en los que confían los laboratorios de investigación y control de calidad.
Póngase en contacto con nuestros expertos hoy mismo para analizar sus requisitos específicos de tratamiento térmico y encontrar la solución perfecta para su proceso.
Guía Visual
Productos relacionados
- Planta de Horno de Pirólisis de Horno Rotatorio Eléctrico Máquina Calcinadora Horno Rotatorio Pequeño Horno Giratorio
- Horno de Tubo Rotatorio Continuo Sellado al Vacío Horno de Tubo Giratorio
- Horno Rotatorio Eléctrico de Trabajo Continuo, Pequeña Planta de Pirólisis con Calefacción de Horno Rotatorio
- Horno Rotatorio Eléctrico Pequeño Horno Rotatorio para Regeneración de Carbón Activado
- Horno de atmósfera controlada con cinta de malla
La gente también pregunta
- ¿Cuáles son las aplicaciones industriales de la pirólisis? Transformar residuos en energía y productos valiosos
- ¿Cuáles son los tipos de reactores de pirólisis utilizados en la industria? Elija la tecnología adecuada para su producto
- ¿Cuál es la diferencia entre calcinación y tostación? Una guía para el procesamiento a alta temperatura
- ¿Cuál es el principio del horno rotatorio? Dominando el Procesamiento Térmico Continuo
- ¿Cuáles son los productos de la pirólisis de la madera? Una guía sobre los rendimientos de biocarbón, bioaceite y gas de síntesis



















