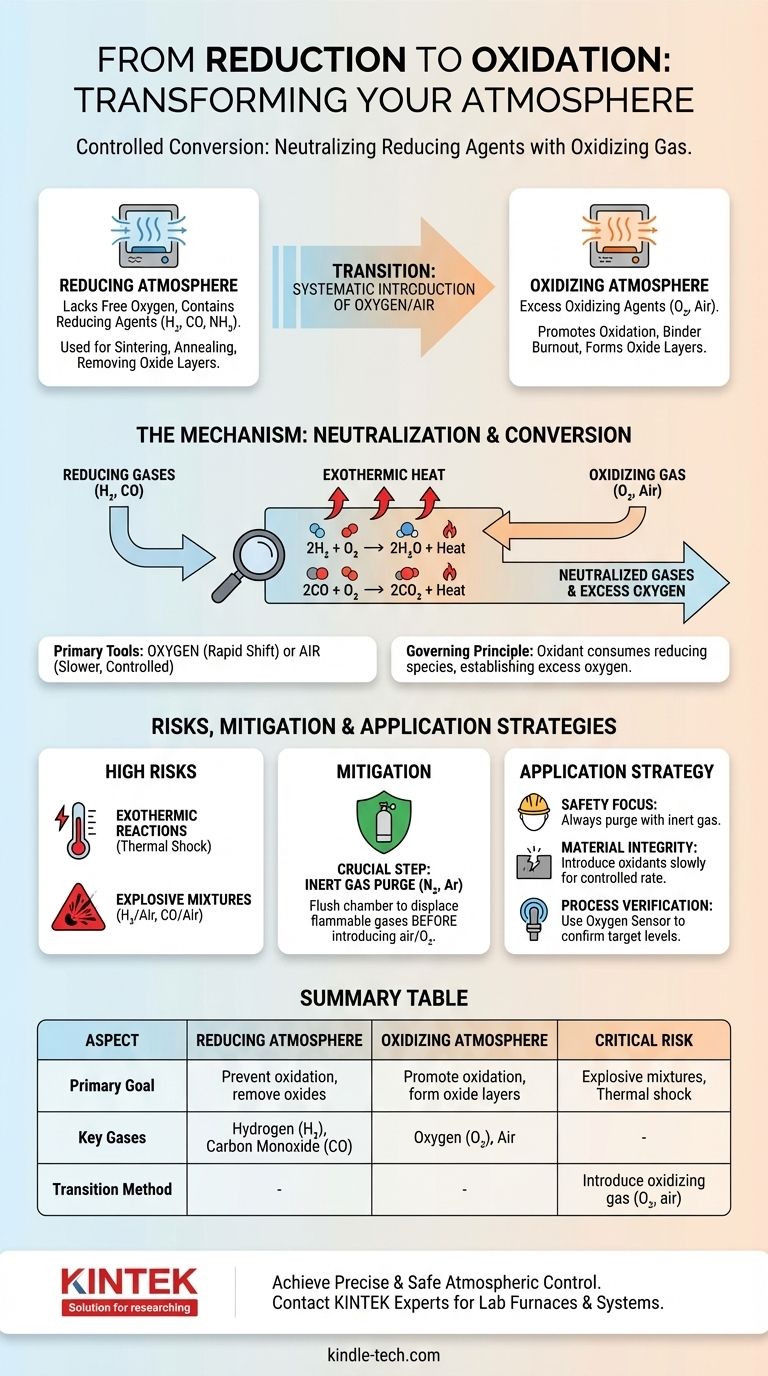
Transformar una atmósfera reductora en una oxidante se logra introduciendo sistemáticamente un gas oxidante, más comúnmente oxígeno o aire. Este proceso neutraliza los agentes reductores activos presentes, como el hidrógeno o el monóxido de carbono, reaccionando con ellos para formar moléculas más estables como el agua y el dióxido de carbono, cambiando fundamentalmente el potencial químico del ambiente.
El cambio de una atmósfera reductora a una oxidante es una conversión química controlada. No se trata meramente de dilución; se trata de suministrar deliberadamente un oxidante para consumir las especies reductoras y crear un exceso de oxígeno.
Comprensión de los Conceptos Fundamentales: Reductora vs. Oxidante
¿Qué Define una Atmósfera Reductora?
Una atmósfera reductora es un ambiente que carece de oxígeno libre y contiene agentes reductores activos. Estos agentes, como el hidrógeno (H₂), el monóxido de carbono (CO) o el amoníaco disociado (NH₃), donan fácilmente electrones o eliminan átomos de oxígeno de los materiales con los que entran en contacto.
Dichas atmósferas se utilizan para prevenir la oxidación o para eliminar activamente las capas de óxido de metales y cerámicas durante el procesamiento a alta temperatura, como la sinterización o el recocido.
¿Qué Define una Atmósfera Oxidante?
Una atmósfera oxidante, por el contrario, tiene un exceso de un agente oxidante, el más ubicuo es el oxígeno (O₂). Este ambiente promueve la oxidación, una reacción en la que un material pierde electrones o se combina con oxígeno.
El aire, que es aproximadamente 21% oxígeno, es la atmósfera oxidante más común. Estos ambientes son esenciales para procesos como la eliminación de aglutinantes en cerámicas o la creación de capas de óxido específicas en la superficie de un material.
El Mecanismo de Transición: De la Reducción a la Oxidación
El Principio: Neutralización por Reacción
La transición se basa en un principio simple: un agente oxidante reaccionará y neutralizará un agente reductor. Para cambiar la atmósfera, debe introducir suficiente oxidante para consumir todos los gases reductores presentes y luego establecer un exceso.
Oxígeno y Aire: Las Herramientas Principales
El oxígeno o el aire son los gases estándar utilizados para esta conversión. La elección entre ellos depende de la velocidad de reacción requerida y del nivel de control necesario.
El oxígeno puro proporciona un cambio más potente y rápido, mientras que el aire permite una transición más lenta, más diluida y, a menudo, más controlable.
Las Reacciones Químicas Gobernantes
Cuando se introduce oxígeno en una atmósfera reductora caliente típica, reacciona inmediatamente con los agentes reductores. Las reacciones primarias son altamente favorables y espontáneas a las temperaturas de procesamiento.
Para una atmósfera de hidrógeno:
2H₂ (gas) + O₂ (gas) → 2H₂O (gas) + Calor
Para una atmósfera de monóxido de carbono:
2CO (gas) + O₂ (gas) → 2CO₂ (gas) + Calor
La atmósfera solo se vuelve verdaderamente oxidante una vez que todo el H₂ o CO se ha convertido en H₂O o CO₂ y se ha establecido un excedente de O₂.
Comprensión de los Riesgos y Compromisos
Alto Riesgo de Reacciones Exotérmicas
Las reacciones que neutralizan los agentes reductores son altamente exotérmicas, lo que significa que liberan una cantidad significativa de calor. Una introducción rápida de oxígeno puede causar un aumento repentino de la temperatura dentro de un horno, lo que podría dañar el equipo o el producto.
Este choque térmico puede agrietar materiales sensibles como las cerámicas o causar transformaciones de fase no deseadas en los metales.
Potencial de Mezclas Explosivas
El riesgo más crítico es la creación de una atmósfera explosiva. Las mezclas de hidrógeno y aire (entre 4% y 75% H₂) o monóxido de carbono y aire (entre 12% y 75% CO) son explosivas.
Si hay una fuente de ignición presente, como un elemento caliente o una descarga estática, una introducción rápida e incontrolada de aire u oxígeno puede causar una explosión violenta. Los protocolos de seguridad son innegociables.
Purga con un Gas Inerte
Para mitigar estos riesgos, a menudo se emplea un paso intermedio crucial: la purga con un gas inerte. Antes de introducir aire, la cámara del horno se purga con un gas como nitrógeno (N₂) o argón (Ar).
Esta purga desplaza el gas reductor inflamable, evitando la formación de una mezcla explosiva cuando finalmente se introduce el oxígeno.
Cómo Aplicar Esto a Su Proceso
Una transición controlada es primordial para la seguridad y para lograr las propiedades deseadas del material. La estrategia correcta depende completamente de su objetivo principal.
- Si su enfoque principal es la seguridad: Siempre purgue el gas reductor con un gas inerte como nitrógeno antes de introducir cualquier cantidad de aire u oxígeno.
- Si su enfoque principal es la integridad del material: Introduzca el gas oxidante lentamente y a una velocidad controlada para evitar el choque térmico de la reacción exotérmica.
- Si su enfoque principal es la verificación del proceso: Utilice un sensor de oxígeno o un analizador de gases en el escape del horno para confirmar que todos los agentes reductores se han consumido y ha alcanzado el nivel de oxígeno deseado.
Dominar esta transición atmosférica le brinda un control preciso sobre el estado químico final y las propiedades físicas de su material.

Tabla Resumen:
| Aspecto | Atmósfera Reductora | Atmósfera Oxidante |
|---|---|---|
| Objetivo Principal | Prevenir la oxidación, eliminar óxidos | Promover la oxidación, formar capas de óxido |
| Gases Clave | Hidrógeno (H₂), Monóxido de Carbono (CO) | Oxígeno (O₂), Aire |
| Método de Transición | Introducir gas oxidante (O₂, aire) para consumir agentes reductores | Se logra después de que los agentes reductores son neutralizados |
| Riesgo Crítico | Formación de mezclas explosivas durante la transición | Choque térmico por reacciones exotérmicas |
Logre un control atmosférico preciso y seguro en su laboratorio.
Dominar la transición de una atmósfera reductora a una oxidante es fundamental para la integridad del material y la seguridad del operador. Ya sea que esté sinterizando metales, recociendo cerámicas o desarrollando nuevos materiales, el equipo y la experiencia adecuados son esenciales.
KINTEK se especializa en hornos de laboratorio y sistemas de control de atmósfera diseñados para una operación precisa, confiable y segura. Nuestras soluciones le ayudan a:
- Prevenir mezclas explosivas con características de seguridad integradas.
- Controlar perfiles térmicos para evitar dañar sus muestras.
- Verificar los resultados del proceso con equipos de monitoreo compatibles.
Deje que KINTEK sea su socio en la excelencia de laboratorio. Contacte a nuestros expertos hoy para discutir sus necesidades específicas de horno y control de atmósfera. Proporcionamos el equipo y los consumibles para garantizar que sus procesos sean exitosos y seguros.
Guía Visual
Productos relacionados
- Horno de Atmósfera Controlada de 1700 ℃ Horno de Atmósfera Inerte de Nitrógeno
- Horno Tubular de Laboratorio de Alta Temperatura de 1700℃ con Tubo de Alúmina
- Horno de atmósfera controlada de 1400 ℃ con nitrógeno y atmósfera inerte
- Horno de mufla de alta temperatura para desaglomeración y pre-sinterización de laboratorio
- Horno de tubo de laboratorio vertical
La gente también pregunta
- ¿Cómo influye un horno de atmósfera de alta temperatura en las cerámicas Si-O-C? Controle su entorno de pirólisis
- ¿Cuál es el papel del uso de un horno de atmósfera de alta temperatura para la pre-carbonización de fibras a base de viscosa? Lograr composites de carbono-carbono de alto rendimiento
- ¿Cuál es el uso del hidrógeno en el horno? Una clave para el procesamiento a alta temperatura sin oxígeno
- ¿Por qué es necesario un ambiente de Argón (Ar) puro durante el proceso de boronización? Proteja su acero contra la oxidación
- ¿Cuál es el papel de un horno de atmósfera de alta temperatura en el crecimiento de películas de óxido alfa-Al2O3 y alfa-Fe2O3?
- ¿Cuáles son las proporciones típicas de aire a gas para los generadores endotérmicos? Optimización de la configuración de gas natural y propano
- ¿Qué son las atmósferas protectoras para el tratamiento térmico? Una guía para prevenir la oxidación y la formación de cascarilla
- ¿Por qué es esencial un horno de oxidación con vapor a alta temperatura para la prueba de rendimiento del revestimiento de combustible con recubrimiento de cromo?



















