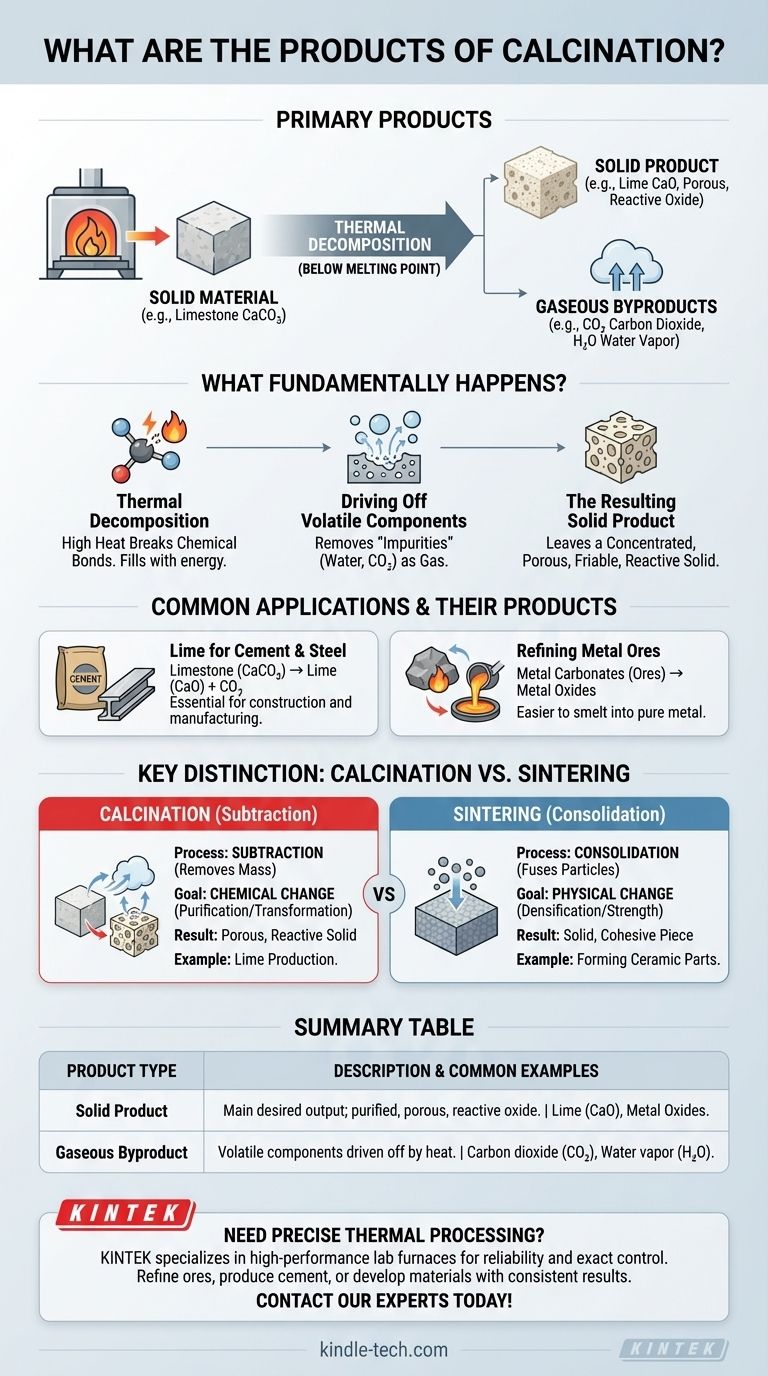
En resumen, los productos primarios de la calcinación son un material sólido que ha sufrido descomposición térmica y uno o más subproductos gaseosos. Por ejemplo, cuando la piedra caliza (carbonato de calcio) se calcina, se descompone en cal sólida (óxido de calcio) y dióxido de carbono gaseoso, que se desprende por el calor. El sólido resultante es el principal producto deseado.
La calcinación es fundamentalmente un proceso de purificación y transformación. Su propósito es calentar un material sólido para descomponerlo químicamente, eliminando componentes volátiles como agua o dióxido de carbono para producir un sólido más concentrado, poroso o reactivo.
¿Qué sucede fundamentalmente durante la calcinación?
El principio de la descomposición térmica
La calcinación es un proceso de descomposición térmica, lo que significa que utiliza altas temperaturas para descomponer un compuesto en sustancias más simples. Críticamente, esto ocurre a una temperatura por debajo del punto de fusión del material.
El proceso fuerza un cambio químico al romper los enlaces. El ejemplo más común es la descomposición de un carbonato en su óxido y dióxido de carbono gaseoso.
Eliminación de componentes volátiles
El objetivo principal de la calcinación es eliminar sustancias "volátiles" que están unidas químicamente dentro del sólido. La referencia lo señala como la "eliminación de impurezas".
Estas sustancias suelen ser agua (de minerales hidratados), dióxido de carbono (de carbonatos como la piedra caliza) u otros compuestos descomponibles. El calentamiento proporciona la energía necesaria para que estos componentes escapen en forma de gas.
El producto sólido resultante
El sólido que queda es el producto principal. A menudo es un óxido del material original, como la cal (CaO) de la piedra caliza (CaCO₃).
A medida que el gas escapa, deja una estructura porosa y friable. Por eso la referencia describe la cal resultante como en una "condición fácilmente pulverizable", lo que aumenta su superficie y reactividad química.
Aplicaciones comunes y sus productos
Producción de cal para cemento
El ejemplo más icónico es la producción de cal a partir de piedra caliza. El producto sólido, la cal (óxido de calcio), es un componente fundamental del cemento y también se utiliza en la fabricación de acero y la producción química.
Refinación de minerales metálicos
La calcinación es un paso vital en la metalurgia. Minerales como el carbonato de zinc (smithsonita) o el carbonato de plomo (cerusita) se calientan para convertirlos en sus respectivos óxidos.
Estos óxidos metálicos son el producto deseado porque son mucho más fáciles de reducir (fundir) a metal puro en un paso posterior.
Comprendiendo la distinción clave: Calcinación vs. Sinterización
Calcinación: Un proceso de sustracción
La calcinación es un proceso sustractivo. Elimina masa del material en forma de gas.
Su objetivo principal es el cambio químico: purificar un material o convertirlo en un intermedio químico más útil. El sólido resultante suele ser más poroso y físicamente más débil.
Sinterización: Un proceso de consolidación
La sinterización, en contraste, es un proceso de consolidación. Utiliza el calor para fusionar o soldar pequeñas partículas, aumentando la densidad y la resistencia del material.
No se produce un cambio químico significativo y no se pierde masa. El objetivo es convertir un polvo en una pieza sólida y cohesiva, como se señala en la referencia.
Tomar la decisión correcta para su objetivo
El proceso que elija depende completamente de lo que necesite que haga el material final.
- Si su objetivo principal es purificar un mineral o crear un intermedio químico como la cal: Está considerando la calcinación, donde el producto clave es el óxido sólido que queda después de la eliminación de los gases volátiles.
- Si su objetivo principal es crear una pieza final fuerte y densa a partir de un polvo: Está considerando la sinterización, donde el producto es una masa sólida formada por la fusión de partículas sin cambio químico.
En última instancia, comprender si necesita descomponer un material o consolidarlo es clave para seleccionar el proceso térmico correcto.

Tabla resumen:
| Tipo de producto | Descripción | Ejemplos comunes |
|---|---|---|
| Producto sólido | El principal resultado deseado; un óxido purificado, poroso y reactivo. | Cal (CaO) de piedra caliza (CaCO₃), óxidos metálicos de minerales. |
| Subproducto gaseoso | Componentes volátiles eliminados por el calor durante la descomposición. | Dióxido de carbono (CO₂), vapor de agua (H₂O). |
¿Necesita equipos de procesamiento térmico precisos para sus proyectos de calcinación o sinterización? KINTEK se especializa en hornos de laboratorio de alto rendimiento y sistemas de procesamiento térmico diseñados para la fiabilidad y el control exacto de la temperatura. Ya sea que esté refinando minerales, produciendo cemento o desarrollando nuevos materiales, nuestro equipo garantiza resultados consistentes y de alta calidad. Contacte a nuestros expertos hoy para encontrar la solución perfecta para las necesidades de su laboratorio.
Guía Visual
Productos relacionados
- Planta de Horno de Pirólisis de Horno Rotatorio Eléctrico Máquina Calcinadora Horno Rotatorio Pequeño Horno Giratorio
- Horno de mufla de 1700℃ para laboratorio
- Horno de Mufla de Laboratorio con Elevación Inferior
- Horno de mufla de alta temperatura para desaglomeración y pre-sinterización de laboratorio
- Horno de mufla de 1800℃ para laboratorio
La gente también pregunta
- ¿Cuáles son los productos de la pirólisis del caucho? Transformando Residuos en Recursos Valiosos
- ¿Cómo se inicia una planta de pirólisis? Una guía paso a paso para lanzar su instalación de conversión de residuos en energía
- ¿Cuáles son las desventajas del proceso de pirólisis flash? Altos costos y riesgos técnicos
- ¿Cuáles son las condiciones del proceso durante la pirólisis rápida? Maximice el rendimiento de bioaceite con un control preciso
- ¿Cómo funciona un horno basculante? Una guía de sistemas de vertido hidráulicos y mecánicos
- ¿Cómo afecta la velocidad de calentamiento a la pirólisis? Controle los rendimientos de los productos para biocarbón, bioaceite o gas de síntesis
- ¿Cuál es el efecto de la temperatura en los productos de la pirólisis? Domine los rendimientos de los productos con el control térmico
- ¿Cuál es el tamaño de una planta de pirólisis? Una guía para adaptar la capacidad a sus necesidades



















