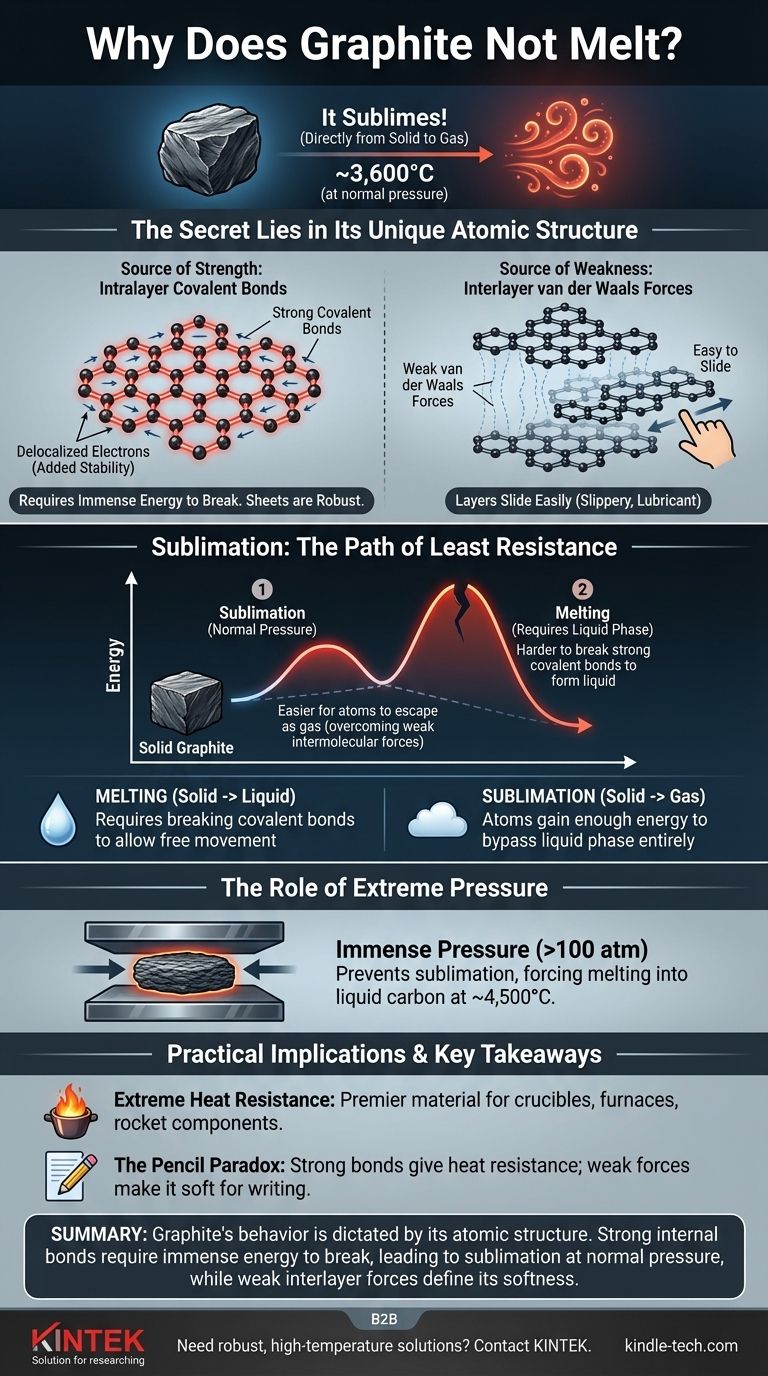
Es un error común pensar que el grafito no se derrite. Bajo presión atmosférica normal, el grafito hace algo diferente: se sublima, pasando directamente de sólido a gas a una temperatura increíblemente alta de alrededor de 3.600°C (6.500°F). Este comportamiento es un resultado directo de la inmensa fuerza de los enlaces químicos que mantienen unidos sus átomos de carbono.
La razón principal de la extrema resistencia al calor del grafito es su estructura atómica única. Consiste en capas de átomos de carbono unidas por enlaces covalentes excepcionalmente fuertes, que requieren una enorme cantidad de energía para romperse y permitir que la sustancia cambie de estado.

Deconstruyendo la estructura atómica del grafito
Para entender por qué el grafito se comporta de esta manera, debemos observar cómo están dispuestos sus átomos de carbono. Su estructura se define por dos tipos de enlaces químicos muy diferentes que actúan al mismo tiempo.
La fuente de fuerza: enlaces covalentes dentro de las capas
El grafito se compone de láminas planas y bidimensionales de átomos de carbono dispuestos en una red hexagonal, similar a un panal.
Dentro de cada lámina, cada átomo de carbono está unido a otros tres mediante fuertes enlaces covalentes. Estos se encuentran entre los enlaces químicos más potentes de la naturaleza.
Además, un electrón de cada átomo de carbono se vuelve deslocalizado, lo que significa que es libre de moverse por toda la lámina. Este intercambio de electrones entre todos los átomos de la capa añade una estabilidad significativa y fortalece aún más los enlaces, haciendo que las láminas sean increíblemente robustas y difíciles de romper.
La fuente de debilidad: fuerzas entre capas
Mientras que los átomos dentro de una capa están fuertemente unidos, las capas mismas se mantienen unidas por fuerzas mucho más débiles conocidas como fuerzas de van der Waals.
Estas fuerzas son lo suficientemente débiles como para que las capas puedan deslizarse fácilmente unas sobre otras. Por eso el grafito se siente resbaladizo y se usa como lubricante y en lápices; al escribir, se dejan capas de grafito en el papel.
Sublimación: el camino de menor resistencia
La diferencia extrema entre los fuertes enlaces dentro de las capas y las débiles fuerzas entre ellas dicta cómo responde el grafito al calor.
Fusión vs. Sublimación
La fusión es el proceso por el cual un sólido se convierte en líquido. Para que esto ocurra, los átomos deben ganar suficiente energía para liberarse de sus posiciones fijas, pero aún así permanecer atraídos entre sí.
La sublimación es la transición directa de un sólido a un gas. En este caso, los átomos ganan tanta energía que omiten por completo la fase líquida y escapan al aire.
Por qué la sublimación gana a presión normal
A presión atmosférica estándar, la energía necesaria para romper los poderosos enlaces covalentes dentro de las capas de grafito es inmensa.
Antes de que la estructura pueda absorber suficiente energía para fundirse en un líquido, los átomos de la superficie ganan suficiente energía para superar las débiles fuerzas intermoleculares y simplemente se desprenden como gas. Es energéticamente más fácil para los átomos escapar directamente a un estado gaseoso que romper los enlaces covalentes necesarios para formar un líquido.
El papel de la presión extrema
El grafito puede ser forzado a fundirse, pero solo bajo condiciones extraordinarias.
Al aplicar una presión inmensa (más de 100 veces la presión atmosférica normal), se puede evitar que los átomos de carbono escapen como gas. Bajo estas condiciones, el grafito se fundirá en carbono líquido a una temperatura de aproximadamente 4.500°C (8.132°F).
Las implicaciones prácticas de esta estructura
Esta estructura única de doble enlace le confiere al grafito un conjunto de propiedades que parecen contradictorias pero que son esenciales para sus aplicaciones industriales.
Resistencia extrema al calor
El alto punto de sublimación convierte al grafito en un material de primera categoría para entornos de alta temperatura. Se utiliza para fabricar crisoles para fundir metales, revestimientos para hornos y componentes en motores de cohetes que deben soportar un calor enorme.
La paradoja del lápiz
La estructura del grafito explica cómo puede ser increíblemente resistente al calor y sorprendentemente blando. La resistencia proviene de los enlaces covalentes dentro de las capas, mientras que la blandura y las propiedades lubricantes provienen de la facilidad con la que estas capas se deslizan unas sobre otras.
Conclusiones clave para entender el grafito
- Si su enfoque principal es su comportamiento bajo el calor: Recuerde que a presión normal, el grafito se sublima directamente a gas porque la energía necesaria para hacerlo es menor que la energía requerida para romper los enlaces covalentes y formar un líquido.
- Si su enfoque principal son sus propiedades físicas: La clave es su estructura en capas. Los enlaces fuertes dentro de las capas proporcionan resistencia al calor, mientras que las fuerzas débiles entre las capas lo hacen blando y un lubricante eficaz.
- Si su enfoque principal es la definición técnica de fusión: El grafito puede fundirse absolutamente, pero solo bajo una presión extremadamente alta que impida que los átomos se sublimen primero.
En última instancia, el comportamiento del grafito es una ilustración perfecta de cómo la estructura atómica de un material dicta sus propiedades en el mundo real.
Tabla resumen:
| Propiedad | Descripción | Razón clave |
|---|---|---|
| Punto de sublimación | ~3.600°C (a presión normal) | Las débiles fuerzas de van der Waals entre las capas permiten que los átomos escapen como gas antes de fundirse. |
| Punto de fusión | ~4.500°C (bajo presión extrema >100 atm) | La alta presión evita la sublimación, forzando la ruptura de los enlaces covalentes para la fusión. |
| Resistencia al calor | Excelente para aplicaciones de alta temperatura | Los enlaces covalentes extremadamente fuertes dentro de las capas de carbono requieren una inmensa energía para romperse. |
¿Necesita soluciones robustas y de alta temperatura para su laboratorio?
Las propiedades únicas del grafito lo convierten en un material esencial para aplicaciones exigentes. En KINTEK, nos especializamos en proporcionar equipos y consumibles de laboratorio de alta calidad, incluyendo crisoles de grafito y componentes de horno, diseñados para soportar condiciones extremas.
Deje que nuestros expertos le ayuden a seleccionar los materiales adecuados para mejorar la eficiencia y seguridad de su laboratorio. Contacte con KINTEK hoy mismo para discutir sus necesidades específicas de alta temperatura.
Guía Visual
Productos relacionados
- Horno Vertical de Vacío de Grafito de Alta Temperatura para Grafización
- Horno de grafización al vacío a ultra alta temperatura de grafito
- Horno de Grafización de Película de Alta Conductividad Térmica de Vacío de Grafito
- Horno Continuo de Grafización al Vacío de Grafito
- Horno de Tubo de Laboratorio de Alta Temperatura de 1400℃ con Tubo de Alúmina
La gente también pregunta
- ¿Es el grafito bueno a altas temperaturas? Desbloqueando su potencial de calor extremo
- ¿A qué temperatura se funde el grafito? Comprendiendo su cambio de fase extremo
- ¿Para qué se utiliza el horno de grafito? Lograr calor extremo de hasta 3000 °C en un entorno controlado
- ¿Por qué la conductividad térmica del grafito es tan alta? Desbloquee una transferencia de calor superior con su estructura única
- ¿Por qué el grafito tiene una alta conductividad térmica? Desbloquee una gestión térmica superior con su estructura única



















