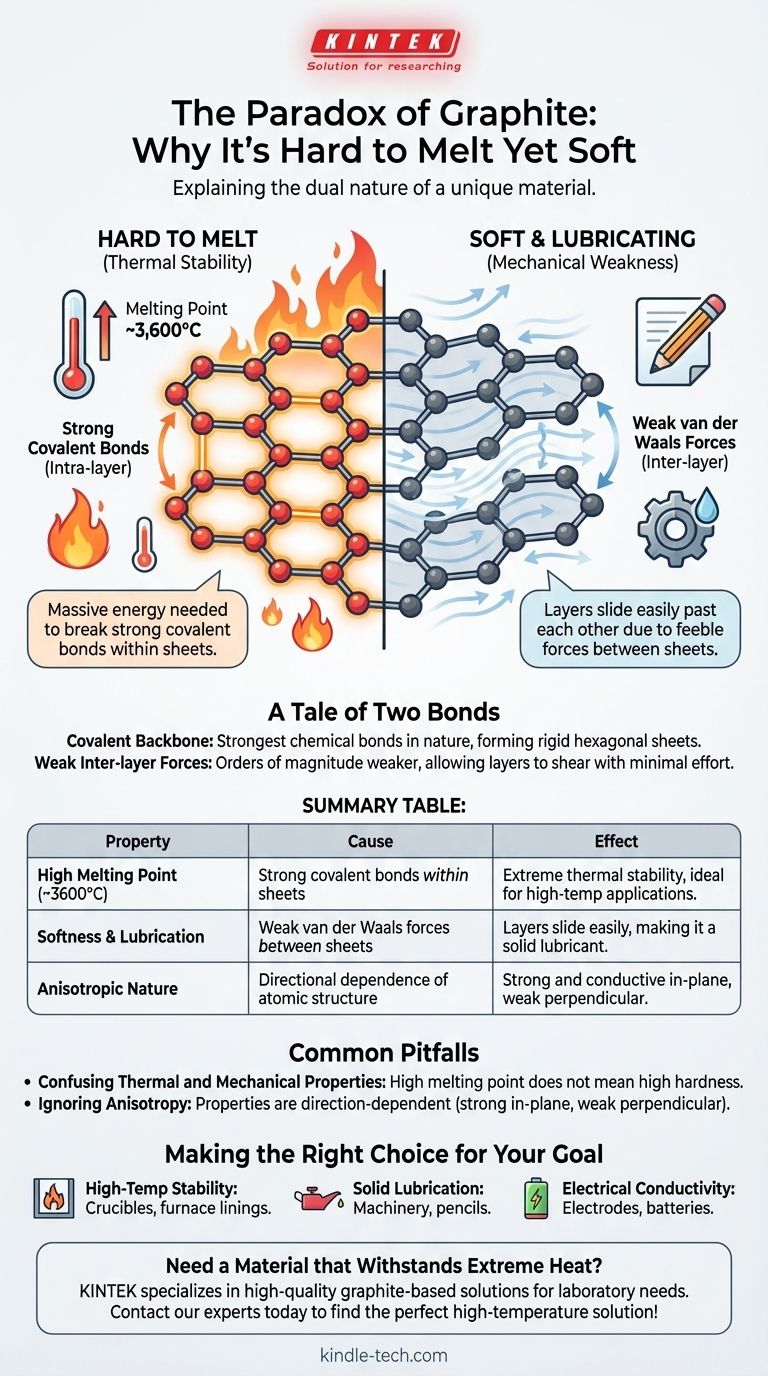
La paradoja del grafito reside en su doble naturaleza: es uno de los materiales más blandos que se conocen, pero posee uno de los puntos de fusión más altos. Este comportamiento se deriva de su estructura atómica única, donde los átomos de carbono están unidos por enlaces covalentes inmensamente fuertes dentro de láminas planas, lo que requiere una enorme cantidad de energía para romper y fundir la sustancia.
Las propiedades del grafito son un cuento de dos fuerzas. La fuerza extrema de los enlaces covalentes dentro de sus capas atómicas dicta su alto punto de fusión, mientras que la profunda debilidad de las fuerzas entre esas capas explica por qué se siente blando y actúa como lubricante.

Un cuento de dos enlaces: La fuente de la resistencia del grafito
La resistencia del grafito a la fusión está arraigada en la forma fundamental en que sus átomos de carbono están conectados. Esta arquitectura interna es increíblemente robusta.
El esqueleto covalente
Cada átomo de carbono en una capa de grafito está unido a otros tres mediante enlaces covalentes. Estos enlaces, que implican el intercambio de electrones entre átomos, se encuentran entre los tipos de enlaces químicos más fuertes de la naturaleza.
Para fundir una sustancia, se debe proporcionar suficiente energía térmica para romper los enlaces que mantienen sus átomos en una estructura sólida y fija. Debido a que los enlaces covalentes del grafito son tan fuertes, la energía necesaria para perturbarlos es inmensa, lo que resulta en un punto de fusión de alrededor de 3.600 °C (6.500 °F).
Las láminas hexagonales
Estos átomos unidos covalentemente forman láminas planas y vastas dispuestas en una red hexagonal, similar a un panal de abejas. Se puede pensar en cada lámina como una sola capa del material maravilloso que es el grafeno.
Dentro de estas láminas, la estructura es rígida y excepcionalmente estable. La fuerza no está solo en una dirección; se distribuye a través de todo el plano bidimensional.
Resolviendo la paradoja: ¿Por qué también es blando?
La explicación de la suavidad del grafito no se encuentra dentro de sus fuertes láminas atómicas, sino en el espacio entre ellas.
Débiles fuerzas intercapa
Mientras que los átomos dentro de una lámina están fuertemente unidos, las láminas en sí están apiladas una encima de la otra con muy poco uniéndolas. Solo son atraídas por débiles fuerzas intermoleculares conocidas como fuerzas de van der Waals.
Estas fuerzas son órdenes de magnitud más débiles que los enlaces covalentes dentro de las láminas.
Las capas deslizantes
Debido a que la atracción entre las capas es tan débil, las láminas pueden deslizarse fácilmente unas sobre otras con un esfuerzo mínimo. Esta acción de deslizamiento es lo que percibimos como suavidad y lo que convierte al grafito en un excelente lubricante sólido.
Cuando escribe con un lápiz, simplemente está cortando miles de estas capas débilmente conectadas y depositándolas sobre el papel.
Intracapa frente a intercapa
Esta distinción es la clave para comprender el grafito. Las fuerzas intracapa (enlaces covalentes) son increíblemente fuertes, lo que le da al grafito su estabilidad térmica. Las fuerzas intercapa (van der Waals) son increíblemente débiles, lo que le confiere su suavidad mecánica.
Errores comunes a evitar
Comprender el grafito significa evitar la simplificación común de que un material es "fuerte" o "débil". Sus propiedades dependen en gran medida del contexto y la dirección.
Confundir propiedades térmicas y mecánicas
Es un error común suponer que un alto punto de fusión debe correlacionarse con una alta dureza mecánica. El grafito es el contraejemplo clásico.
Su estabilidad térmica (resistencia a la fusión) está determinada por sus fuertes enlaces covalentes. Sus propiedades mecánicas (suavidad y resistencia al corte) están determinadas por sus débiles fuerzas intercapa.
Ignorar la anisotropía
El grafito es un material altamente anisotrópico, lo que significa que sus propiedades dependen de la dirección.
Es extremadamente fuerte y conduce bien el calor y la electricidad a lo largo del plano de sus láminas atómicas. Sin embargo, es mecánicamente débil y un mal conductor perpendicularmente a esas láminas.
Tomar la decisión correcta para su objetivo
Esta doble naturaleza convierte al grafito en un material excepcionalmente versátil, pero su aplicación debe alinearse con sus propiedades direccionales específicas.
- Si su enfoque principal es la estabilidad a alta temperatura: El grafito es una excelente opción para aplicaciones como crisoles o revestimientos de hornos porque sus fuertes enlaces covalentes resisten la descomposición térmica.
- Si su enfoque principal es la lubricación sólida: Las capas deslizantes y débilmente unidas del grafito lo hacen ideal para reducir la fricción en maquinaria, cerraduras o como la "mina" de los lápices.
- Si su enfoque principal es la conductividad eléctrica: La estructura permite que los electrones se muevan libremente a lo largo de las láminas, lo que convierte al grafito en un material útil para electrodos, baterías y escobillas en motores eléctricos.
Reconocer que las propiedades macroscópicas de un material son un resultado directo de su estructura atómica es la clave para resolver cualquier desafío de ingeniería.
Tabla de resumen:
| Propiedad | Causa | Efecto |
|---|---|---|
| Alto punto de fusión (~3600°C) | Fuertes enlaces covalentes dentro de las láminas atómicas | Estabilidad térmica extrema, ideal para aplicaciones a alta temperatura |
| Suavidad y lubricación | Débiles fuerzas de van der Waals entre las láminas | Las capas se deslizan fácilmente, convirtiéndolo en un lubricante sólido |
| Naturaleza anisotrópica | Dependencia direccional de la estructura atómica | Fuerte y conductor en el plano, débil perpendicular a él |
¿Necesita un material que resista el calor extremo?
Las propiedades únicas del grafito lo convierten en una opción ideal para hornos de alta temperatura, crisoles y otros equipos de laboratorio exigentes. En KINTEK, nos especializamos en proporcionar equipos y consumibles de laboratorio de alta calidad, incluidas soluciones a base de grafito, para satisfacer sus necesidades específicas de laboratorio.
¡Contacte con nuestros expertos hoy mismo para encontrar la solución perfecta a alta temperatura para su aplicación!
Guía Visual
Productos relacionados
- Horno de grafización al vacío a ultra alta temperatura de grafito
- Horno Vertical de Vacío de Grafito de Alta Temperatura para Grafización
- Horno Continuo de Grafización al Vacío de Grafito
- Horno de Grafización de Película de Alta Conductividad Térmica de Vacío de Grafito
- Horno de Tubo de Laboratorio de Alta Temperatura de 1400℃ con Tubo de Alúmina
La gente también pregunta
- ¿Cuál es la diferencia entre la tipografía en frío y la tipografía en caliente? Descubra la Revolución de la Imprenta
- ¿Es viable la pirólisis? Una guía para el éxito económico, tecnológico y ambiental
- ¿Qué tan gruesa es la deposición de película delgada? Una guía para el rango de nanómetros a micrómetros
- ¿Cuál es la temperatura del sustrato en la pulverización catódica? Domine la calidad de la película delgada con un control térmico preciso
- ¿Cuál es la importancia del proceso de sinterización en la fabricación? Desbloqueando la precisión y la durabilidad del material
- ¿Qué productos se fabrican mediante sinterización láser? Desde implantes médicos hasta piezas aeroespaciales
- ¿Cuáles son las funciones de un sistema de agitación de laboratorio para mejorar la eficiencia de lixiviación de desechos de oro?
- ¿Qué tan precisa es el análisis por FRX? Una guía sobre la precisión del análisis elemental



















