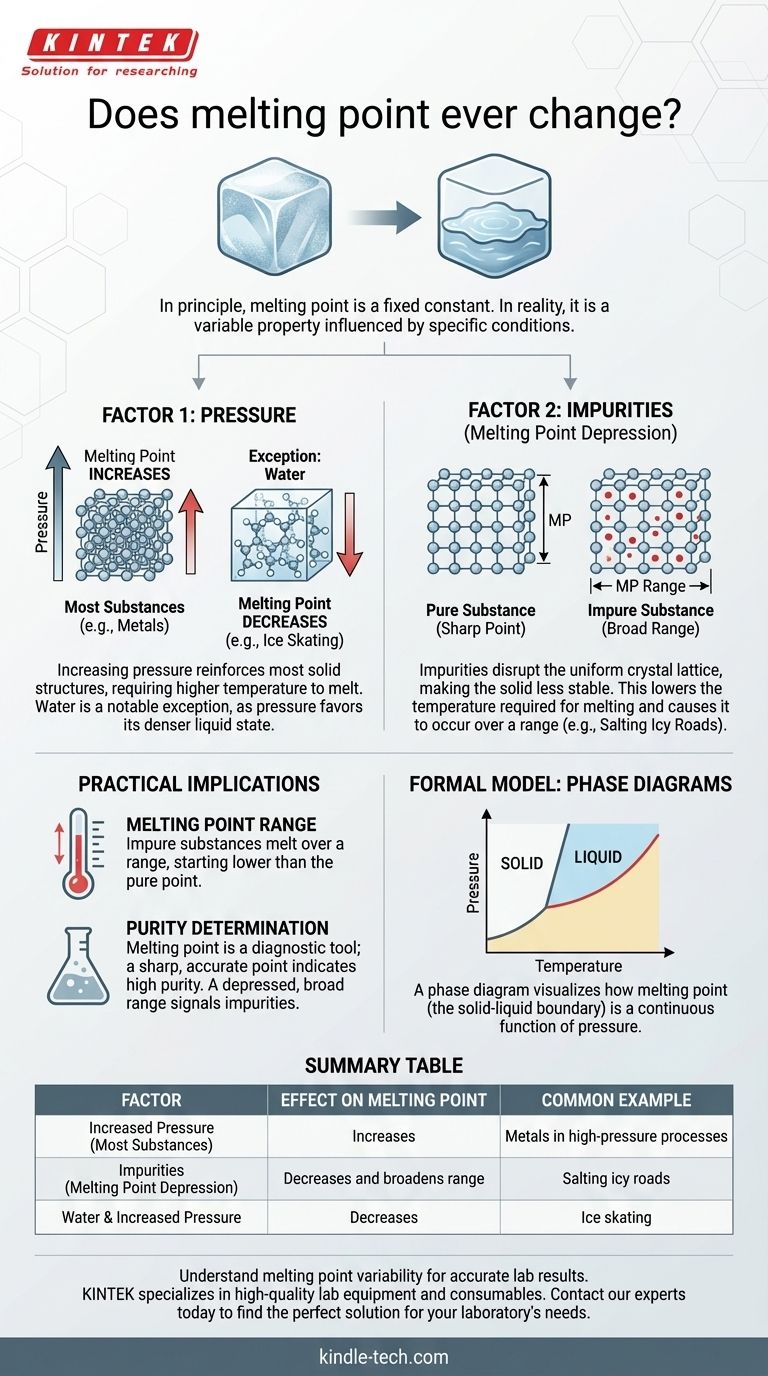
En principio, el punto de fusión de una sustancia pura es una constante física fija. Sin embargo, en el mundo real, la temperatura observada a la que se funde una sustancia puede cambiar absolutamente. Esto no es un cambio arbitrario; es una respuesta predecible a dos factores principales: los cambios en la presión ambiental y la introducción de impurezas en la sustancia.
Si bien los libros de texto a menudo presentan el punto de fusión como un número estático, se entiende con mayor precisión como una propiedad que es constante solo bajo un conjunto específico de condiciones. Comprender cómo la presión y la pureza influyen en esta propiedad es la clave para predecir y controlar su comportamiento en cualquier aplicación del mundo real.

Los dos factores que alteran el punto de fusión
El punto de fusión "oficial" de una sustancia, como el agua a 0 °C (32 °F), se mide en condiciones estándar, generalmente a una atmósfera de presión y con la sustancia en un estado de alta pureza. Cuando no se cumplen estas condiciones, el punto de fusión se desviará.
Factor 1: La influencia de la presión
Para la mayoría de las sustancias, aumentar la presión externa obliga a las moléculas a adoptar una disposición más compacta. Esto refuerza la estructura sólida, requiriendo más energía (una temperatura más alta) para romper los enlaces y pasar al estado líquido.
Por lo tanto, para la gran mayoría de los materiales, un aumento de la presión conduce a un aumento del punto de fusión.
Sin embargo, existe una excepción crítica y famosa: el agua. El agua sólida (hielo) es menos densa que el agua líquida, por eso los icebergs flotan. Aumentar la presión sobre el hielo favorece el estado más denso: el agua líquida. Esto significa que bajo mayor presión, el hielo se derrite a una temperatura más baja. Esta es la razón por la cual la cuchilla de un patín de hielo, al ejercer una alta presión sobre una línea delgada, puede crear una capa microscópica de agua sobre la cual deslizarse.
Factor 2: El papel de las impurezas
Esta es la razón más común de un cambio en el punto de fusión fuera de un laboratorio de alta presión. Cuando se introduce una impureza (un soluto) en una sustancia pura (un disolvente), interrumpe la red cristalina uniforme y repetitiva del sólido.
Esta interrupción hace que la estructura sólida sea menos estable. Como resultado, se necesita menos energía para descomponerla y convertirla en líquido. Este fenómeno se conoce como descenso crioscópico (o depresión del punto de fusión).
Un ejemplo clásico es echar sal en las carreteras heladas. La sal se mezcla con el hielo, disminuyendo su punto de fusión. Esto permite que el hielo se derrita incluso cuando la temperatura ambiente del aire todavía está por debajo del punto de congelación normal del agua.
Comprender las implicaciones prácticas
Reconocer que el punto de fusión puede cambiar no es solo un ejercicio académico. Tiene consecuencias significativas en entornos científicos e industriales, donde a menudo se utiliza como herramienta de diagnóstico.
De un "Punto" a un "Rango"
Un sólido cristalino puro generalmente se derrite a una temperatura muy nítida y específica. Cuando se comienza a calentarlo, la temperatura aumenta hasta alcanzar el punto de fusión, donde se mantiene constante hasta que todo el sólido se ha convertido en líquido.
Una sustancia impura se comporta de manera diferente. No se derrite a una sola temperatura, sino en un rango de punto de fusión. La fusión comienza a una temperatura más baja que para la sustancia pura y se completa a una temperatura más cercana, aunque a menudo todavía por debajo, del punto de fusión de la sustancia pura.
Uso del punto de fusión para determinar la pureza
Este "defecto" es en realidad una característica increíblemente útil. En un laboratorio de química, una de las primeras y más rápidas formas de evaluar la pureza de un compuesto cristalino sintetizado es medir su punto de fusión.
Si el compuesto se funde en un rango amplio y a una temperatura inferior al valor de referencia, es una señal clara de que hay impurezas presentes y es necesaria una purificación adicional. Un punto de fusión nítido que coincida con el valor establecido es un fuerte indicador de alta pureza.
El modelo formal: Diagramas de fases
La relación entre la presión, la temperatura y el estado de una sustancia (sólido, líquido, gas) se captura formalmente en un diagrama de fases.
Un mapa de estados físicos
Un diagrama de fases es un gráfico con la presión en el eje Y y la temperatura en el eje X. Las líneas en el gráfico delimitan los límites donde la sustancia transiciona entre diferentes fases.
El límite sólido-líquido
La línea que separa la fase sólida de la fase líquida en este diagrama representa el punto de fusión a cada presión posible. Al observar este gráfico, queda claro al instante que el punto de fusión no es un número único, sino una función continua de la presión. Este modelo visual unifica los conceptos y demuestra que el punto de fusión es inherentemente variable.
Tomar la decisión correcta para su objetivo
Su perspectiva sobre el punto de fusión debe dictarse por su objetivo.
- Si su enfoque principal es la síntesis o el análisis químico: Trate el punto de fusión como una herramienta de diagnóstico crucial para la pureza. Un punto de fusión nítido y preciso confirma el éxito, mientras que un rango deprimido y amplio indica la necesidad de purificación.
- Si su enfoque principal es la ciencia de materiales o la ingeniería: Debe tener en cuenta las variaciones de presión en sus diseños. El punto de fusión de un material a nivel del mar puede no ser el mismo en un proceso industrial de alta presión o en una aplicación en las profundidades de la tierra.
- Si su enfoque principal es comprender los fenómenos cotidianos: Utilice el principio de descenso crioscópico para explicar por qué salamos las carreteras en invierno o por qué añadir sal a un baño de agua helada lo hace más frío para hacer helado.
En última instancia, reconocer que el punto de fusión es una propiedad dinámica, no un número estático, lo transforma de un hecho simple a una poderosa herramienta predictiva.
Tabla de resumen:
| Factor | Efecto sobre el punto de fusión | Ejemplo común |
|---|---|---|
| Aumento de la presión | Aumenta (para la mayoría de las sustancias) | Metales en procesos de alta presión |
| Impurezas (Descenso crioscópico) | Disminuye y amplía el rango | Salazón de carreteras heladas |
| Agua y aumento de la presión | Disminuye | Patinaje sobre hielo |
¿Necesita un control preciso de la temperatura para su trabajo de laboratorio?
Comprender la variabilidad del punto de fusión es fundamental para una síntesis y un análisis precisos. KINTEK se especializa en equipos y consumibles de laboratorio de alta calidad, incluido el aparato de punto de fusión, diseñado para ofrecer la fiabilidad y precisión que exige su laboratorio.
Permítanos ayudarle a lograr resultados consistentes y precisos. Contacte con nuestros expertos hoy mismo para encontrar la solución perfecta para las necesidades de su laboratorio.
Guía Visual
Productos relacionados
- Horno de Mufla de Laboratorio con Elevación Inferior
- Horno de mufla de 1800℃ para laboratorio
- Horno de mufla de 1400 ℃ para laboratorio
- Horno de mufla de 1700℃ para laboratorio
- Horno de Tubo de Laboratorio de Alta Temperatura de 1400℃ con Tubo de Alúmina
La gente también pregunta
- ¿Cuál es el beneficio de la sinterización? Logre un rendimiento superior del material y la fabricación de piezas complejas
- ¿Cuál es la temperatura del desaglomerado térmico? Una guía para ciclos controlados de eliminación de aglutinantes
- ¿Qué es el ciclo de tratamiento térmico? Domina las 3 etapas para controlar las propiedades del metal
- ¿Cuál es el mejor material para fresas de extremo? Una guía de dureza vs. tenacidad para su aplicación
- ¿Por qué se utiliza un horno de secado para el tratamiento a baja temperatura de Ti/Al2O3? Garantizar la pureza y la fluidez del polvo
- ¿Qué es el pulverizado catódico superficial (sputtering)? Una guía para la deposición y el grabado de películas delgadas de precisión
- ¿Qué es el sputtering en la fabricación? Una guía para la deposición de películas delgadas de precisión
- ¿Qué es el vidrio recubierto por pulverización catódica? Descubra la tecnología de control solar de alto rendimiento



















