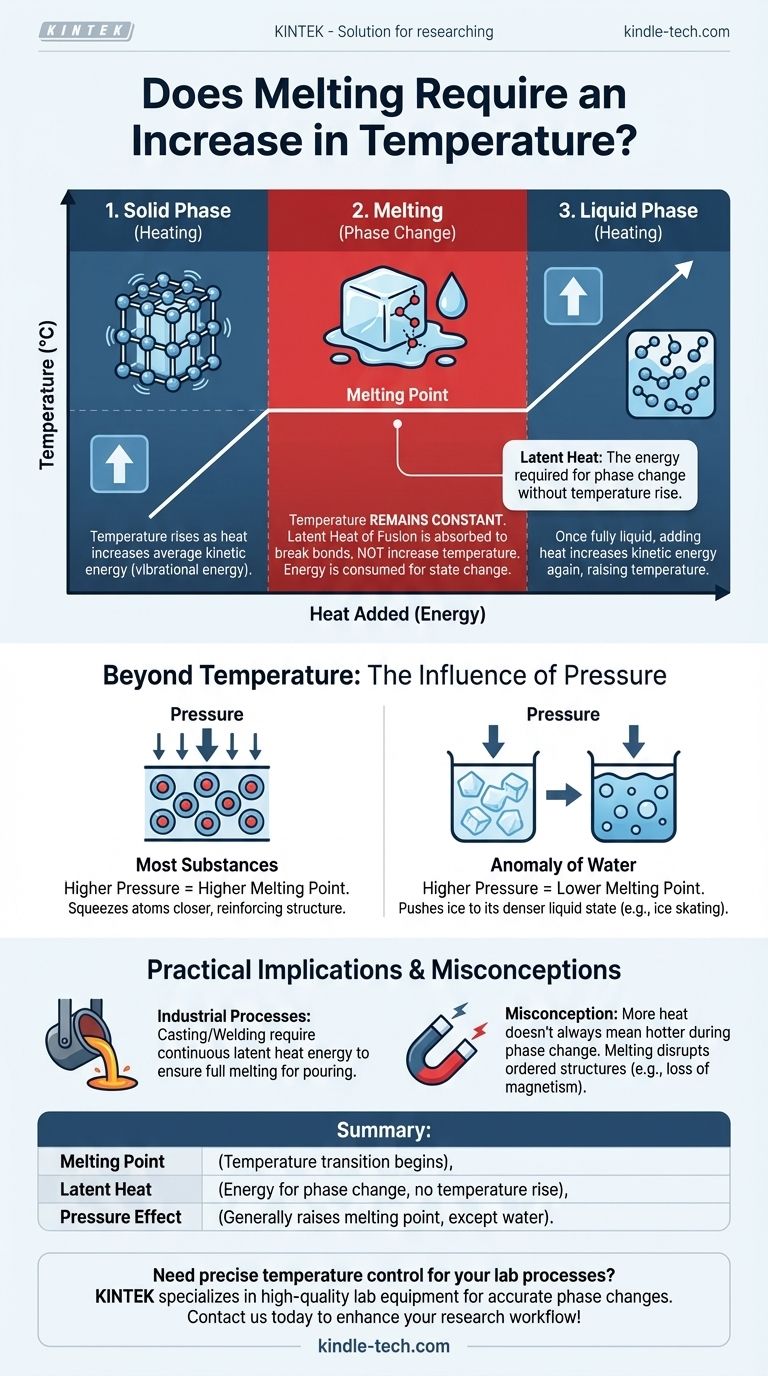
La relación entre calor, temperatura y fusión a menudo se malinterpreta. Para fundir un sólido, debe añadir energía en forma de calor. Este proceso primero eleva la temperatura de la sustancia hasta que alcanza su punto de fusión específico. Sin embargo, durante la transición real de sólido a líquido, la temperatura permanece constante incluso cuando se suministra más calor.
Si bien una sustancia debe calentarse primero hasta su punto de fusión, el proceso de fusión en sí ocurre a una temperatura constante. La energía añadida, conocida como calor latente, se utiliza para romper los enlaces de la estructura sólida, no para aumentar la temperatura general de la sustancia.

La física de un cambio de fase
Para comprender por qué la fusión ocurre a una temperatura constante, primero debemos distinguir entre calor y temperatura. Están relacionados, pero no son lo mismo.
¿Qué es la temperatura?
La temperatura es una medida de la energía cinética promedio de los átomos o moléculas dentro de una sustancia. En un sólido, estos átomos están encerrados en una estructura fija, como una red cristalina, pero vibran constantemente. A medida que añade calor, aumenta esta energía vibracional, lo que medimos como un aumento de la temperatura.
Alcanzando el punto de fusión
A medida que continúa añadiendo calor, los átomos vibran cada vez más violentamente. Finalmente, alcanzan un nivel de energía en el que las vibraciones son lo suficientemente fuertes como para comenzar a romper los enlaces rígidos que los mantienen en sus posiciones fijas. Esta temperatura específica es el punto de fusión.
El papel del calor latente
En el punto de fusión, ocurre un cambio crítico. Cualquier energía térmica adicional que suministre —conocida como el calor latente de fusión— se utiliza ahora exclusivamente para romper los enlaces restantes de la estructura sólida. No se utiliza para hacer que las moléculas vibren más rápido.
Debido a que la energía se consume para cambiar el estado de la sustancia (de sólido a líquido) en lugar de aumentar su energía cinética, la temperatura permanece perfectamente constante hasta que todo el sólido se ha convertido en líquido.
El estado líquido
Una vez que el último trozo de sólido se ha fundido, la sustancia está completamente en estado líquido. A partir de este punto, cualquier calor adicional que añada aumentará nuevamente la energía cinética de las moléculas, haciendo que la temperatura del líquido aumente.
Más allá de la temperatura: la influencia de la presión
La temperatura no es el único factor que rige la fusión. La presión juega un papel crucial, y a veces contraintuitivo.
Cómo afecta la presión a la fusión
Para la mayoría de las sustancias, el aumento de la presión externa eleva el punto de fusión. La alta presión comprime físicamente los átomos, reforzando la estructura sólida. Esto significa que se requiere más energía (y, por lo tanto, una temperatura más alta) para romper los enlaces y permitir que la sustancia se funda.
La anomalía del agua
El agua es una excepción notable. La forma sólida del agua (hielo) es menos densa que su forma líquida. El aumento de la presión sobre el hielo lo empuja hacia su estado más denso: el agua líquida. Esto significa que bajo alta presión, el hielo puede fundirse a una temperatura por debajo de su punto de fusión estándar de 0°C (32°F). Este principio contribuye a cómo la cuchilla de un patín de hielo se desliza sobre el hielo.
Implicaciones prácticas y conceptos erróneos
Comprender este proceso no es solo académico; tiene consecuencias directas en la ciencia y la ingeniería.
Concepto erróneo: más calor siempre significa más caliente
El concepto erróneo más común es que añadir calor continuamente siempre hará que algo esté más caliente. Durante un cambio de fase, como la fusión o la ebullición, esto es incorrecto. La entrada de energía está realizando el trabajo de cambiar el estado del material, no aumentando su temperatura.
Por qué esto es importante en la práctica
En procesos industriales como la fundición o la soldadura de metales, este principio es crítico. Un horno no solo debe llevar un metal a su punto de fusión, sino también suministrar una cantidad significativa y continua de energía adicional (el calor latente) para asegurar que toda la masa se vuelva completamente líquida para el vertido. De manera similar, la fusión altera la estructura atómica ordenada de los materiales. Por eso, calentar una pieza de acero magnetizada más allá de cierto punto (su temperatura de Curie, que está relacionada pero es distinta de su punto de fusión) hará que pierda su magnetismo, ya que los dominios magnéticos organizados se rompen.
Tomando la decisión correcta para su objetivo
Su aplicación determina qué parte de este proceso es más importante para usted.
- Si su enfoque principal es comprender la física básica: Recuerde que la temperatura es constante durante un cambio de fase; la energía añadida se llama calor latente y se utiliza para cambiar el estado.
- Si su enfoque principal es la ciencia o ingeniería de materiales: Reconozca que la fusión completa de una sustancia requiere una entrada de energía precisa y continua, incluso después de haber alcanzado su temperatura de fusión.
- Si está considerando los efectos ambientales: Tenga en cuenta que la presión puede alterar significativamente el punto de fusión de una sustancia, aumentándolo para la mayoría de los materiales pero disminuyéndolo para una excepción importante como el agua.
Comprender esta distinción entre temperatura y energía térmica es fundamental para controlar y predecir el comportamiento de cualquier material.
Tabla resumen:
| Concepto | Descripción |
|---|---|
| Punto de fusión | Temperatura donde un sólido comienza a transicionar a líquido. |
| Calor latente de fusión | Energía absorbida durante la fusión sin cambio de temperatura. |
| Efecto de la presión | La alta presión eleva el punto de fusión (excepto para el agua, que lo disminuye). |
| Aplicación práctica | Crítico para procesos industriales como la fundición y soldadura de metales. |
¿Necesita un control preciso de la temperatura para los procesos de su laboratorio? KINTEK se especializa en equipos de laboratorio de alta calidad, incluidos hornos y sistemas de calefacción, diseñados para manejar cambios de fase como la fusión con precisión. Ya sea que trabaje con metales, polímeros u otros materiales, nuestras soluciones garantizan una gestión eficiente de la energía y resultados consistentes. Contáctenos hoy para explorar cómo nuestro equipo de laboratorio puede mejorar su investigación o flujo de trabajo de producción.
Guía Visual
Productos relacionados
- Horno de Mufla de Laboratorio con Elevación Inferior
- Horno de mufla de 1800℃ para laboratorio
- Horno de mufla de 1700℃ para laboratorio
- Horno de mufla de 1400 ℃ para laboratorio
- Horno de Tubo de Laboratorio de Alta Temperatura de 1400℃ con Tubo de Alúmina
La gente también pregunta
- ¿Cuáles son los peligros del calor en un laboratorio? Proteja su laboratorio de quemaduras, incendios y pérdida de datos
- ¿Cuál es la diferencia entre película barrida y película delgada? Descubra el método de destilación adecuado para su proceso
- ¿Cuál es la diferencia entre un horno eléctrico y un horno de arco eléctrico? Una guía de métodos de calentamiento industrial
- ¿Cómo afecta la presión a la pirólisis? Controlar los rendimientos de los productos desde el bioaceite hasta el gas de síntesis
- ¿Es la deposición lo opuesto a la sublimación? Entendiendo la transición de fase directa
- ¿Por qué los polímeros intrínsecos de autorreparación requieren calentamiento? Desbloquee la reparación repetible con activación térmica
- ¿Cuál es la necesidad técnica de utilizar un agitador horizontal a temperatura constante? Asegurar extractos de compost precisos
- ¿Para qué se utiliza el haz de electrones? Una solución de alta velocidad y no térmica para la esterilización y mejora de materiales



















