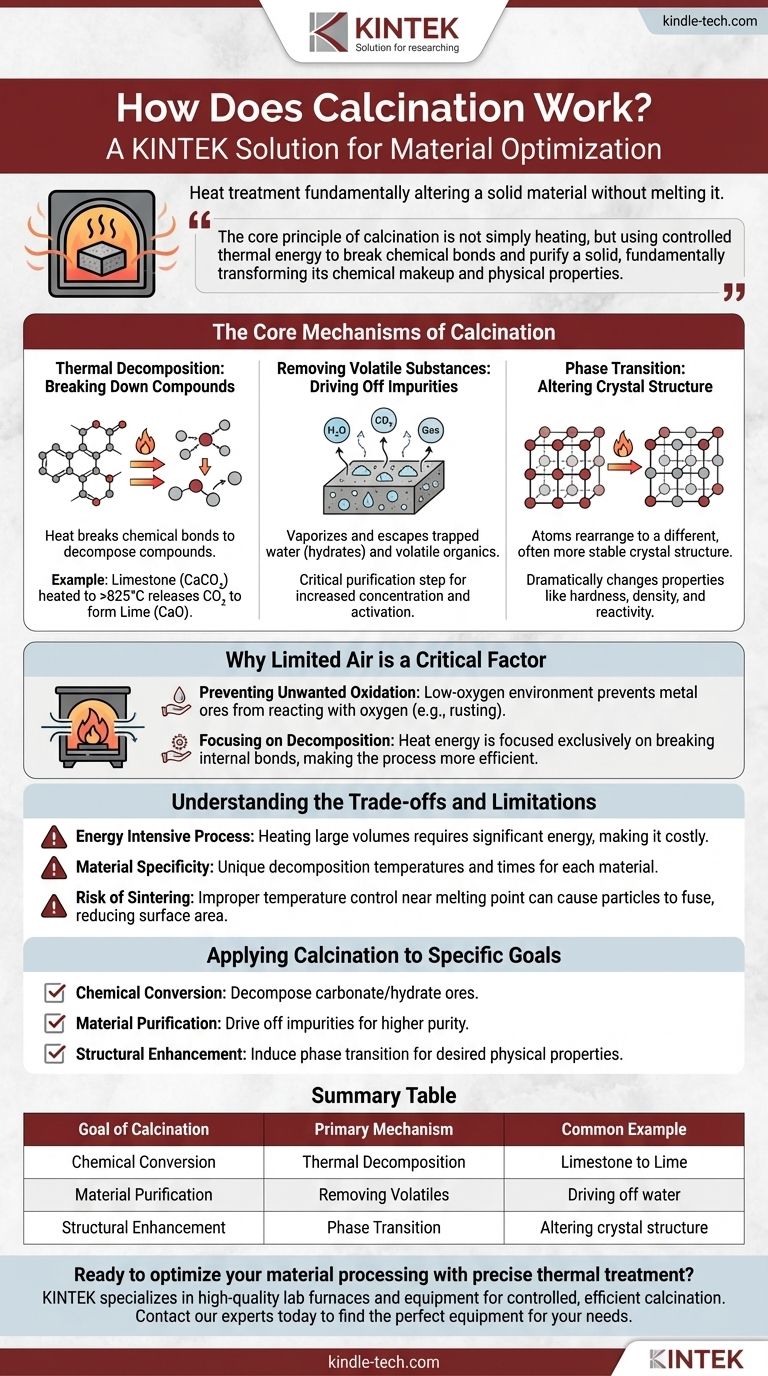
En esencia, la calcinación es un proceso de tratamiento térmico que altera fundamentalmente un material sólido sin fundirlo. Al calentar una sustancia a alta temperatura en un ambiente con bajo contenido de oxígeno, se fuerza la descomposición térmica, se eliminan impurezas volátiles como el agua y el dióxido de carbono, o se cambia la estructura cristalina interna del material.
El principio central de la calcinación no es simplemente calentar, sino utilizar energía térmica controlada para romper enlaces químicos y purificar un sólido, transformando fundamentalmente su composición química y propiedades físicas.

Los mecanismos centrales de la calcinación
Para comprender cómo funciona la calcinación, debe observar los tres cambios principales que puede inducir en un material cuando se somete a altas temperaturas.
Descomposición térmica: Descomposición de compuestos
Este es el objetivo más común de la calcinación. El calor proporciona la energía necesaria para romper los enlaces químicos dentro de un compuesto, lo que provoca su descomposición en sustancias más simples.
El ejemplo clásico es la producción de cal (óxido de calcio) a partir de piedra caliza (carbonato de calcio). Cuando se calienta a más de 825 °C (1517 °F), la piedra caliza se descompone, liberando gas dióxido de carbono y dejando atrás la cal purificada.
Eliminación de sustancias volátiles: Eliminación de impurezas
Muchos materiales en bruto contienen agua atrapada (hidratos) u otros compuestos orgánicos volátiles. La calcinación calienta el material hasta un punto en el que estas sustancias se vaporizan y escapan.
Este es un paso de purificación crítico, que deja una versión más concentrada o anhidra (sin agua) del material deseado. Esto aumenta la pureza y puede "activar" el material para procesos posteriores.
Transición de fase: Alteración de la estructura cristalina
A veces, el objetivo no es cambiar la composición química, sino alterar la forma física del material.
Calentar puede hacer que los átomos de un sólido se reorganicen en una estructura cristalina diferente, a menudo más estable o útil. Esto se conoce como transición de fase y puede cambiar drásticamente propiedades como la dureza, la densidad y la reactividad.
Por qué el aire limitado es un factor crítico
La condición de utilizar un suministro limitado de aire (o nada de aire) es lo que distingue la calcinación de otros tratamientos térmicos como la tostación.
Prevención de la oxidación no deseada
Muchos minerales metálicos, cuando se calientan en presencia de oxígeno, reaccionan con él para formar un óxido. Este es el mismo proceso básico que la oxidación.
Al realizar el calentamiento en un ambiente con bajo contenido de oxígeno, la calcinación evita específicamente que ocurran estas reacciones de oxidación no deseadas, asegurando que se produzca el cambio químico deseado.
Enfoque en la descomposición
Con el oxígeno eliminado de la ecuación, la energía térmica aplicada se centra exclusivamente en una tarea: romper los enlaces internos del material en sí. Esto hace que el proceso sea más eficiente y predecible para su propósito previsto.
Comprensión de las compensaciones y limitaciones
Aunque es potente, la calcinación es un proceso industrial preciso con consideraciones importantes.
Proceso intensivo en energía
Calentar grandes volúmenes de materiales sólidos a cientos o incluso miles de grados requiere una cantidad significativa de energía. Esto lo convierte en un paso costoso y que consume muchos recursos en cualquier cadena de producción.
Especificidad del material
No existe una temperatura universal para la calcinación. Cada material tiene una temperatura de descomposición y un tiempo de calentamiento requeridos únicos. Lo que funciona perfectamente para la piedra caliza puede ser completamente ineficaz o incluso destructivo para otro tipo de mineral.
Riesgo de sinterización
Si la temperatura se controla incorrectamente y se acerca demasiado al punto de fusión del material, las partículas pueden comenzar a fusionarse. Este proceso, llamado sinterización, puede reducir el área superficial y la reactividad del producto final, lo cual a menudo no es deseable.
Aplicación de la calcinación a objetivos específicos
La decisión de utilizar la calcinación depende totalmente del resultado deseado.
- Si su enfoque principal es la conversión química: La calcinación es el método ideal para descomponer un mineral de carbonato o hidrato en una forma de óxido más útil.
- Si su enfoque principal es la purificación del material: Utilice la calcinación para eliminar impurezas volátiles como el agua o los disolventes residuales, creando un producto final más concentrado y puro.
- Si su enfoque principal es la mejora estructural: Aplique la calcinación para inducir una transición de fase, cambiando la estructura cristalina del material para lograr las propiedades físicas deseadas.
En última instancia, la calcinación es una herramienta fundamental para diseñar con precisión la composición química y las propiedades físicas de los materiales sólidos.
Tabla de resumen:
| Objetivo de la calcinación | Mecanismo principal | Ejemplo común |
|---|---|---|
| Conversión química | Descomposición térmica | Piedra caliza (CaCO₃) a Cal (CaO) |
| Purificación del material | Eliminación de volátiles | Eliminación de agua de un hidrato |
| Mejora estructural | Transición de fase | Alteración de la estructura cristalina de un material |
¿Listo para optimizar el procesamiento de sus materiales con un tratamiento térmico preciso? El proceso de calcinación es fundamental para lograr las propiedades químicas y físicas adecuadas en sus materiales. KINTEK se especializa en hornos y equipos de laboratorio de alta calidad diseñados para una calcinación controlada y eficiente. Ya sea que se encuentre en investigación, desarrollo o producción, nuestras soluciones le ayudan a eliminar impurezas, inducir transiciones de fase y lograr resultados superiores. Póngase en contacto con nuestros expertos hoy mismo para encontrar el equipo de calcinación perfecto para las necesidades específicas de su laboratorio.
Guía Visual
Productos relacionados
- Horno de mufla de 1800℃ para laboratorio
- Horno de mufla de 1700℃ para laboratorio
- Horno de Mufla de Laboratorio con Elevación Inferior
- Horno de mufla de 1400 ℃ para laboratorio
- Horno de mufla de alta temperatura para desaglomeración y pre-sinterización de laboratorio
La gente también pregunta
- ¿Qué es la mufla en un horno de mufla? La clave para un procesamiento a alta temperatura libre de contaminación
- ¿Cuál es la importancia de un horno de mufla? Logre un calentamiento de alta pureza y sin contaminantes
- ¿Qué es un horno de mufla y cómo funciona? Logre un calentamiento limpio y de alta temperatura para su laboratorio
- ¿Cómo se utiliza un horno mufla en un laboratorio? Una guía paso a paso para un funcionamiento seguro y preciso
- ¿Para qué se utiliza un horno de mufla? Logre un procesamiento a alta temperatura con pureza



















