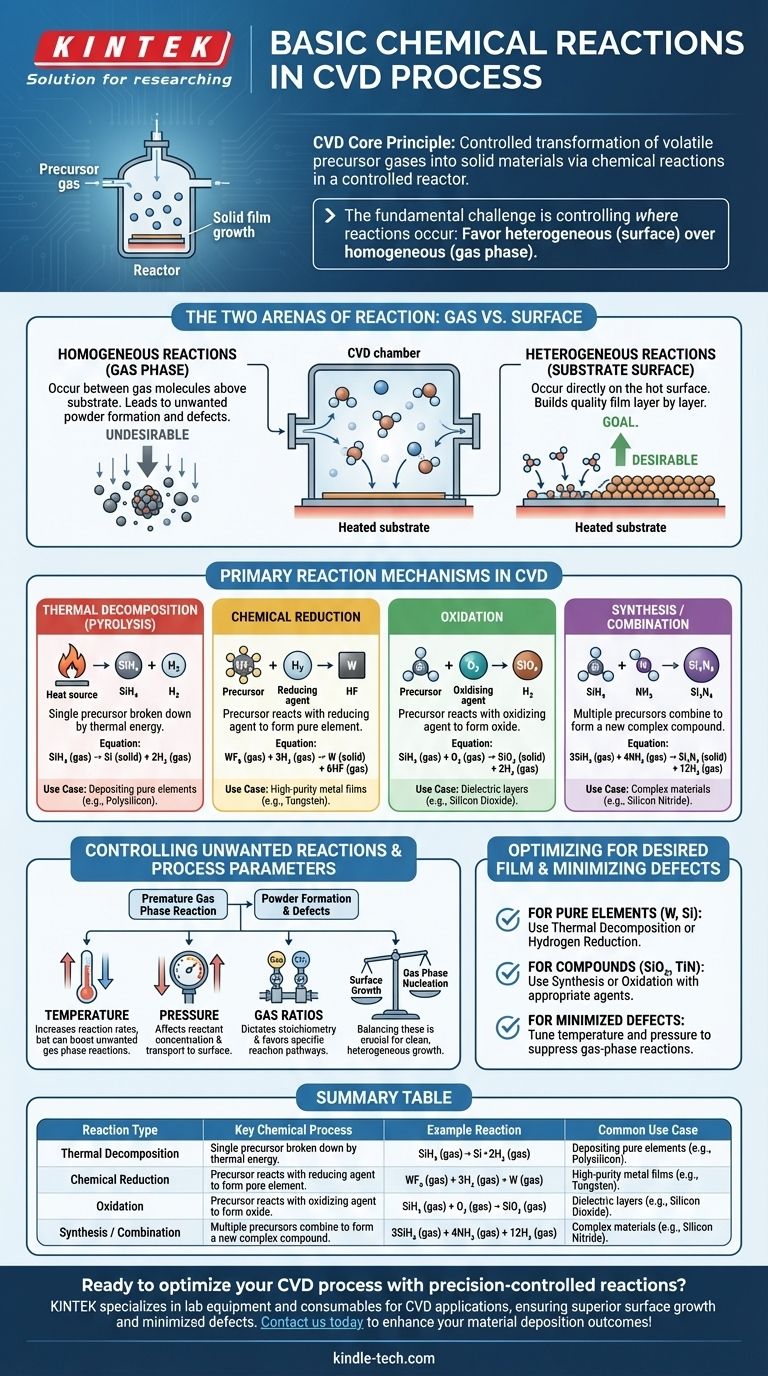
En esencia, la Deposición Química de Vapor (CVD) es un proceso de reacciones químicas controladas. Estas reacciones están diseñadas para tomar gases precursores estables y volátiles y transformarlos en un material sólido y no volátil directamente sobre un sustrato. Los mecanismos más comunes que impulsan esta transformación son la descomposición térmica (pirólisis), la reducción química, la oxidación y las reacciones de síntesis, todas ocurriendo dentro de un entorno de reactor altamente controlado.
El desafío fundamental en cualquier proceso CVD no es solo iniciar las reacciones químicas, sino controlar con precisión dónde ocurren. El objetivo es favorecer las reacciones heterogéneas en la superficie del sustrato para construir una película de calidad, minimizando al mismo tiempo las reacciones homogéneas en la fase gaseosa que crean partículas no deseadas.

Las Dos Zonas de Reacción: Gas vs. Superficie
Cada reacción química en una cámara CVD ocurre en uno de estos dos lugares. El equilibrio entre ellas determina la calidad y la estructura del material final.
Reacciones Homogéneas (En la Fase Gaseosa)
Estas reacciones ocurren entre las moléculas de gas, suspendidas en el espacio por encima del sustrato.
Si bien algo de química en fase gaseosa es necesaria para crear especies intermedias reactivas, las reacciones homogéneas excesivas suelen ser indeseables. Pueden conducir a la formación de partículas sólidas o "polvos" que luego caen sobre el sustrato, causando defectos y comprometiendo la calidad de la película.
Reacciones Heterogéneas (En la Superficie del Sustrato)
Estas son las reacciones que construyen la película. Ocurren directamente sobre, o en una capa muy delgada adyacente a, la superficie caliente del sustrato.
El objetivo de un proceso CVD bien diseñado es maximizar la velocidad de las reacciones heterogéneas. Los gases precursores se adsorben en la superficie caliente, se descomponen o reaccionan con otras especies adsorbidas, y forman la película sólida estable capa atómica por capa atómica.
Mecanismos de Reacción Primarios en CVD
Aunque ocurren en una de las dos "zonas" anteriores, las reacciones en sí se pueden clasificar en varios tipos clave según la transformación química involucrada.
Descomposición Térmica (Pirólisis)
Este es el tipo de reacción CVD más simple y común. Un único gas precursor se descompone en sus partes constituyentes solo por energía térmica.
El calor del sustrato proporciona la energía necesaria para romper los enlaces químicos de la molécula precursora, dejando que el elemento sólido deseado se deposite en la superficie. Un ejemplo clásico es la deposición de polisilicio a partir de gas silano.
SiH₄ (gas) → Si (sólido) + 2H₂ (gas)
Reducción Química
En este proceso, un gas precursor (a menudo un haluro metálico) reacciona con un agente reductor, típicamente hidrógeno (H₂), para formar una película elemental pura.
Este es un método común para depositar películas metálicas de alta pureza como el tungsteno. El hidrógeno elimina los átomos de halógeno del precursor metálico, permitiendo que el metal puro se deposite.
WF₆ (gas) + 3H₂ (gas) → W (sólido) + 6HF (gas)
Oxidación
Esta reacción involucra un gas precursor que reacciona con un agente oxidante, como oxígeno (O₂), óxido nitroso (N₂O) o vapor de agua (H₂O), para formar una película de óxido sólido.
Este es el proceso fundamental para crear capas dieléctricas aislantes como el dióxido de silicio (SiO₂), un componente crítico en casi toda la microelectrónica moderna.
SiH₄ (gas) + O₂ (gas) → SiO₂ (sólido) + 2H₂ (gas)
Síntesis o Combinación
Aquí, se introducen dos o más gases precursores para combinarse y formar un nuevo material compuesto sobre el sustrato. Esto permite la creación de materiales complejos que no se pueden formar por simple descomposición.
Por ejemplo, el nitruro de silicio (Si₃N₄), un material duro y químicamente resistente, se forma haciendo reaccionar una fuente de silicio con una fuente de nitrógeno, como el amoníaco.
3SiH₄ (gas) + 4NH₃ (gas) → Si₃N₄ (sólido) + 12H₂ (gas)
Comprender las Compensaciones: Controlar las Reacciones no Deseadas
El éxito de un proceso CVD depende enteramente de controlar el entorno de reacción para favorecer las vías químicas deseadas.
El Problema de la Formación de Polvo
La principal dificultad en CVD es la nucleación no intencionada en fase gaseosa. Si la temperatura del reactor es demasiado alta o la presión es demasiado grande, los gases precursores pueden reaccionar prematuramente en la fase gaseosa (reacción homogénea) antes de llegar al sustrato. Esto crea partículas que pueden causar defectos o formar una película polvorienta de baja densidad en lugar de una de alta calidad y densa.
El Papel de los Parámetros del Proceso
Los ingenieros utilizan varios parámetros clave como palancas para controlar la cinética y la ubicación de la reacción:
- Temperatura: Aumenta las velocidades de reacción, pero también puede aumentar las reacciones no deseadas en fase gaseosa.
- Presión: Afecta la concentración de reactivos y la rapidez con la que viajan a la superficie.
- Relaciones de Gases: Dicta la estequiometría y controla qué vía de reacción se favorece.
El equilibrio de estos factores es crucial para promover un crecimiento heterogéneo limpio en la superficie del sustrato.
Optimización de Reacciones para la Película Deseada
La vía de reacción química específica que emplee está determinada enteramente por el material que pretende crear.
- Si su enfoque principal es depositar un elemento puro (p. ej., Tungsteno, Silicio): Probablemente confiará en la descomposición térmica o en una reacción de reducción con hidrógeno utilizando un precursor único y posiblemente un agente reductor.
- Si su enfoque principal es crear un óxido o nitruro compuesto (p. ej., SiO₂, TiN): Utilizará una reacción de síntesis u oxidación, introduciendo un agente oxidante o nitrurante junto con su precursor principal.
- Si su enfoque principal es minimizar los defectos y lograr una película de alta calidad: Su tarea principal es ajustar la temperatura y la presión para suprimir las reacciones homogéneas en fase gaseosa y promover un crecimiento heterogéneo limpio en el sustrato.
En última instancia, dominar CVD es dominar el arte de dirigir la química para que ocurra en un momento y lugar específicos.
Tabla de Resumen:
| Tipo de Reacción | Proceso Químico Clave | Reacción de Ejemplo | Caso de Uso Común |
|---|---|---|---|
| Descomposición Térmica (Pirólisis) | Un precursor único se descompone por calor | SiH₄ (gas) → Si (sólido) + 2H₂ (gas) | Deposición de elementos puros como el polisilicio |
| Reducción Química | El precursor reacciona con un agente reductor (p. ej., H₂) | WF₆ (gas) + 3H₂ (gas) → W (sólido) + 6HF (gas) | Películas metálicas de alta pureza (p. ej., tungsteno) |
| Oxidación | El precursor reacciona con un agente oxidante (p. ej., O₂) | SiH₄ (gas) + O₂ (gas) → SiO₂ (sólido) + 2H₂ (gas) | Capas dieléctricas como el dióxido de silicio |
| Síntesis/Combinación | Múltiples precursores se combinan para formar un compuesto | 3SiH₄ (gas) + 4NH₃ (gas) → Si₃N₄ (sólido) + 12H₂ (gas) | Materiales complejos como el nitruro de silicio |
¿Listo para optimizar su proceso CVD con reacciones controladas con precisión? KINTEK se especializa en equipos de laboratorio y consumibles para aplicaciones CVD, ayudándole a lograr películas delgadas sin defectos a través de soluciones de reactor personalizadas. Ya sea que esté depositando metales, óxidos o nitruros, nuestra experiencia garantiza un crecimiento superior de la superficie y defectos minimizados en fase gaseosa. ¡Contáctenos hoy para discutir cómo nuestros sistemas CVD pueden mejorar sus resultados de deposición de materiales!
Guía Visual
Productos relacionados
- Equipo de horno de tubo de deposición química de vapor mejorada por plasma inclinado PECVD
- Equipo de sistema de máquina HFCVD para recubrimiento de nanodiamante de matriz de trefilado
- Sistema de Reactor de Deposición Química de Vapor de Plasma de Microondas de Máquina de Diamantes MPCVD de 915MHz
- Máquina de horno de prensa en caliente al vacío para laminación y calentamiento
- Materiales de Diamante Dopado con Boro por CVD de Laboratorio
La gente también pregunta
- ¿Puede la deposición química de vapor asistida por plasma (PECVD) depositar metales? ¿Por qué el PECVD rara vez se utiliza para la deposición de metales?
- ¿Cuál es el proceso de PECVD en semiconductores? Habilitando la deposición de películas delgadas a baja temperatura
- ¿Cómo mejoran los sistemas PECVD los recubrimientos DLC en implantes? Se explica la durabilidad superior y la biocompatibilidad
- ¿Cuáles son los diferentes tipos de películas delgadas? Una guía de función, material y métodos de deposición
- ¿Cómo se depositan las películas delgadas? Una guía sobre los métodos PVD vs. CVD para su aplicación



















