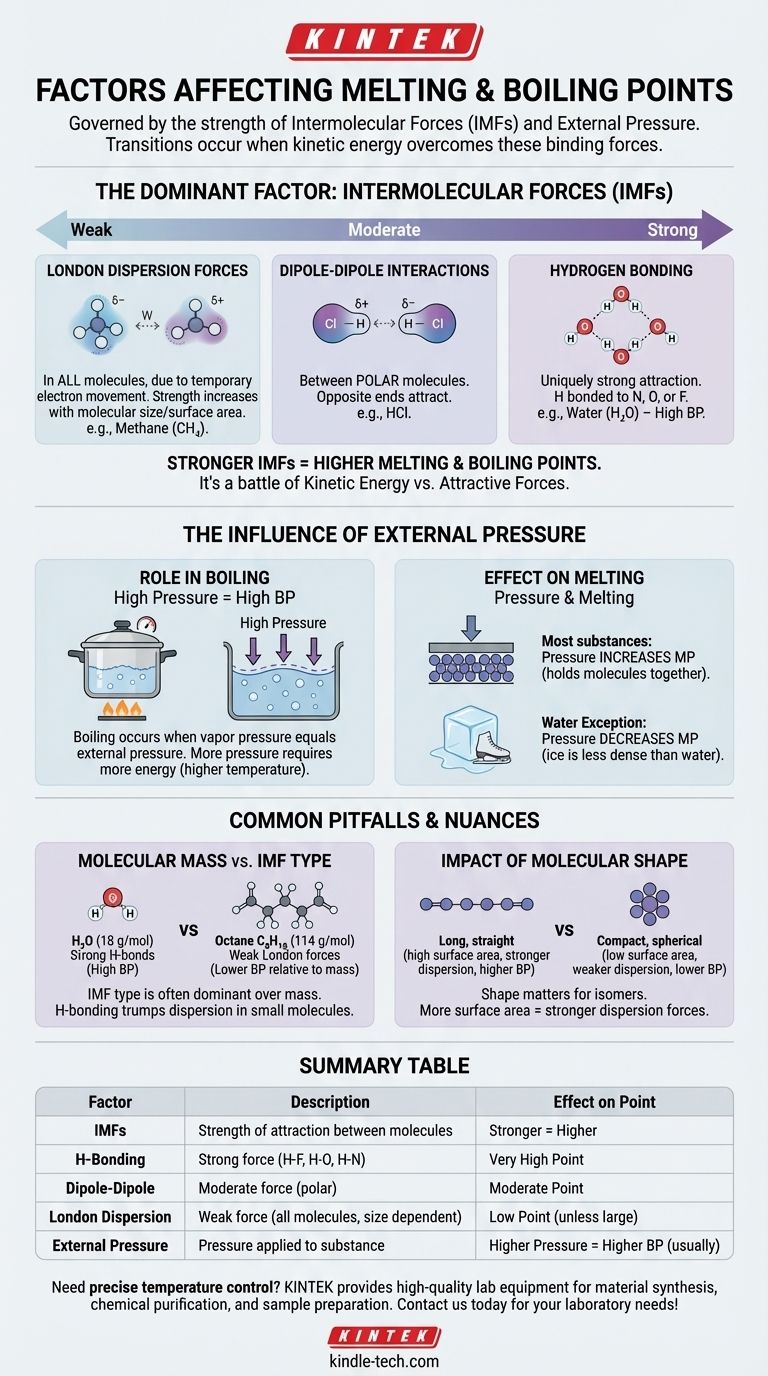
A un nivel fundamental, los puntos de fusión y ebullición de una sustancia están regidos por dos factores primarios: la fuerza de las fuerzas intermoleculares (FIM) que mantienen unidas sus moléculas y la presión externa que se le aplica. Esencialmente, estas transiciones ocurren cuando las moléculas obtienen suficiente energía para superar las fuerzas que las unen y la presión que las contiene.
La conclusión principal es que la fusión y la ebullición no se tratan solo de la temperatura; son una batalla física entre la energía cinética de una molécula y las fuerzas atractivas que la unen a sus vecinas. Cuanto más fuertes sean esas atracciones, más energía se requerirá para separarlas.

El factor dominante: Fuerzas intermoleculares (FIM)
El factor más importante para determinar los puntos de fusión y ebullición de una sustancia es la fuerza de las atracciones entre sus moléculas individuales. Estos no son los fuertes enlaces covalentes dentro de una molécula, sino las fuerzas más débiles que hacen que las moléculas se adhieran entre sí.
¿Qué son las fuerzas intermoleculares?
Piensa en las FIM como el equivalente molecular de los imanes. Algunas moléculas son como potentes electroimanes, mientras que otras son como imanes débiles de nevera. Superar esta "adherencia" requiere energía en forma de calor.
La jerarquía de las fuerzas
Las fuerzas intermoleculares varían en fuerza, creando una jerarquía clara. Comprender esta jerarquía es clave para predecir qué sustancias tendrán puntos de ebullición más altos o más bajos.
Enlaces de hidrógeno (más fuertes) Este es un tipo de atracción excepcionalmente fuerte que ocurre cuando el hidrógeno está unido a un átomo altamente electronegativo como el nitrógeno (N), el oxígeno (O) o el flúor (F). El agua (H₂O) es el ejemplo clásico, y sus potentes enlaces de hidrógeno son la razón por la que tiene un punto de ebullición tan notablemente alto para su pequeño tamaño.
Interacciones dipolo-dipolo (moderadas) Estas fuerzas existen entre moléculas polares —moléculas que tienen una carga parcial positiva permanente en un extremo y una carga parcial negativa en el otro. Estos extremos opuestos se atraen entre sí, manteniendo la sustancia unida moderadamente bien.
Fuerzas de dispersión de London (más débiles) Estas fuerzas existen en todas las moléculas, causadas por el movimiento temporal y aleatorio de los electrones que crea dipolos fugaces. Aunque individualmente son débiles, se vuelven más significativas a medida que aumenta el tamaño y la superficie de la molécula. Por eso, las moléculas más grandes como el octano (C₈H₁₈) son líquidas a temperatura ambiente, mientras que las más pequeñas como el metano (CH₄) son gases.
La influencia de la presión externa
La presión externa actúa como una tapa física sobre una sustancia, dificultando que las moléculas escapen a la siguiente fase (de sólido a líquido, o de líquido a gas).
El papel de la presión en la ebullición
La ebullición ocurre cuando la presión de vapor interna de un líquido iguala la presión atmosférica externa.
Si aumentas la presión externa (por ejemplo, usando una olla a presión), elevas el punto de ebullición porque las moléculas necesitan más energía para empujar contra esa fuerza externa más fuerte.
Por el contrario, si disminuyes la presión externa (por ejemplo, yendo a una altitud elevada), disminuyes el punto de ebullición. Por eso el agua hierve a una temperatura más baja en Denver que a nivel del mar.
El efecto de la presión en la fusión
Para la mayoría de las sustancias, el aumento de la presión aumenta ligeramente el punto de fusión. Esto se debe a que la presión ayuda a mantener las moléculas en la estructura rígida y compacta de un sólido.
El agua es una excepción famosa. Debido a que el hielo sólido es menos denso que el agua líquida, la aplicación de presión en realidad facilita su fusión. Por eso la cuchilla de un patinador sobre hielo puede deslizarse sobre el hielo.
Errores comunes y matices
Simplemente observar un factor puede ser engañoso. La interacción entre fuerzas, masa y forma crea matices importantes.
Masa molecular vs. fuerza intermolecular
Si bien los puntos de ebullición generalmente aumentan con la masa molar, el tipo de FIM es mucho más dominante.
Una molécula pequeña con fuertes enlaces de hidrógeno, como el agua (18 g/mol, hierve a 100°C), tendrá un punto de ebullición mucho más alto que una molécula de tamaño similar con solo fuerzas de dispersión débiles, como el metano (16 g/mol, hierve a -161.5°C).
El impacto de la forma molecular
Para moléculas con la misma fórmula química (isómeros), la forma importa. Las moléculas largas y rectas tienen más superficie de contacto, lo que lleva a fuerzas de dispersión de London más fuertes y puntos de ebullición más altos.
Las moléculas compactas y esféricas tienen menos superficie y, por lo tanto, atracciones más débiles y puntos de ebullición más bajos.
Haciendo la predicción correcta
Al combinar estos principios, puedes evaluar con precisión por qué las diferentes sustancias se comportan como lo hacen.
- Si tu enfoque principal es comparar diferentes sustancias: Primero, identifica la fuerza intermolecular más fuerte presente en cada una; esta será casi siempre el determinante principal de sus puntos de ebullición relativos.
- Si tu enfoque principal es cambiar las condiciones de una sustancia: Analiza cómo los cambios en la presión externa afectarán la energía requerida para una transición de fase, especialmente para la ebullición.
- Si encuentras un resultado inesperado: Considera factores secundarios como la forma molecular o las propiedades de densidad únicas de la sustancia, como se ve con el agua.
Al comprender estos principios fundamentales, puedes pasar de simplemente memorizar los puntos de fusión y ebullición a comprender verdaderamente el comportamiento físico de la materia.
Tabla resumen:
| Factor | Descripción | Efecto en el punto de fusión/ebullición |
|---|---|---|
| Fuerzas intermoleculares (FIM) | Fuerza de atracción entre moléculas. | Fuerzas más fuertes = Punto más alto |
| Enlaces de hidrógeno | Fuerza fuerte con enlaces H-F, H-O, H-N. | Punto muy alto |
| Dipolo-dipolo | Fuerza moderada entre moléculas polares. | Punto moderado |
| Dispersión de London | Fuerza débil en todas las moléculas, aumenta con el tamaño. | Punto bajo (a menos que la molécula sea grande) |
| Presión externa | Presión aplicada a la sustancia. | Mayor presión = Mayor punto de ebullición (generalmente) |
¿Necesitas un control preciso de la temperatura para tus procesos de laboratorio? Comprender las transiciones de fase es fundamental para aplicaciones como la síntesis de materiales, la purificación química y la preparación de muestras. En KINTEK, nos especializamos en equipos de laboratorio de alta calidad, incluidos hornos, estufas y sistemas de control de temperatura, diseñados para ofrecer la precisión y fiabilidad que tu investigación exige. Deja que nuestros expertos te ayuden a seleccionar el equipo perfecto para tu aplicación específica. ¡Contáctanos hoy para hablar sobre tus necesidades de laboratorio!
Guía Visual
Productos relacionados
- Horno de tratamiento térmico al vacío y horno de fusión por inducción de levitación
- Horno de Fusión por Inducción al Vacío para Fusión por Inducción
- Horno de Fusión por Inducción al Vacío a Escala de Laboratorio
- Máquina de prensa hidráulica automática con calefacción y placas calientes para prensa caliente de laboratorio 25T 30T 50T
- Máquina de prensa hidráulica calentada con placas calentadas manuales integradas para uso en laboratorio
La gente también pregunta
- ¿Cómo se ioniza el argón en la pulverización catódica? La clave para encender un plasma estable
- ¿Cómo se comparan las bombas de paletas rotativas con las bombas de vacío de anillo líquido? Eligiendo la bomba de vacío adecuada para su proceso
- ¿Cuáles son los componentes del rotavapor? Domine el sistema central para una eliminación eficiente de disolventes
- ¿Afecta la temperatura a la compresión de los gases? Por qué los gases calientes resisten más la compresión
- ¿Por qué es crítico el control programado de la temperatura para los catalizadores Ce-TiOx/npAu? Logre precisión en la activación del catalizador
- ¿Por qué es importante ajustar la temperatura del congelador a las recomendaciones de almacenamiento? Optimice la seguridad alimentaria y el uso de energía
- ¿Cuál es el proceso de pulverización catódica de oro? Una guía para la deposición de películas delgadas de alta precisión
- ¿Cuáles son las ventajas y desventajas del grafito? Dominando el rendimiento a alta temperatura frente al riesgo de contaminación






















