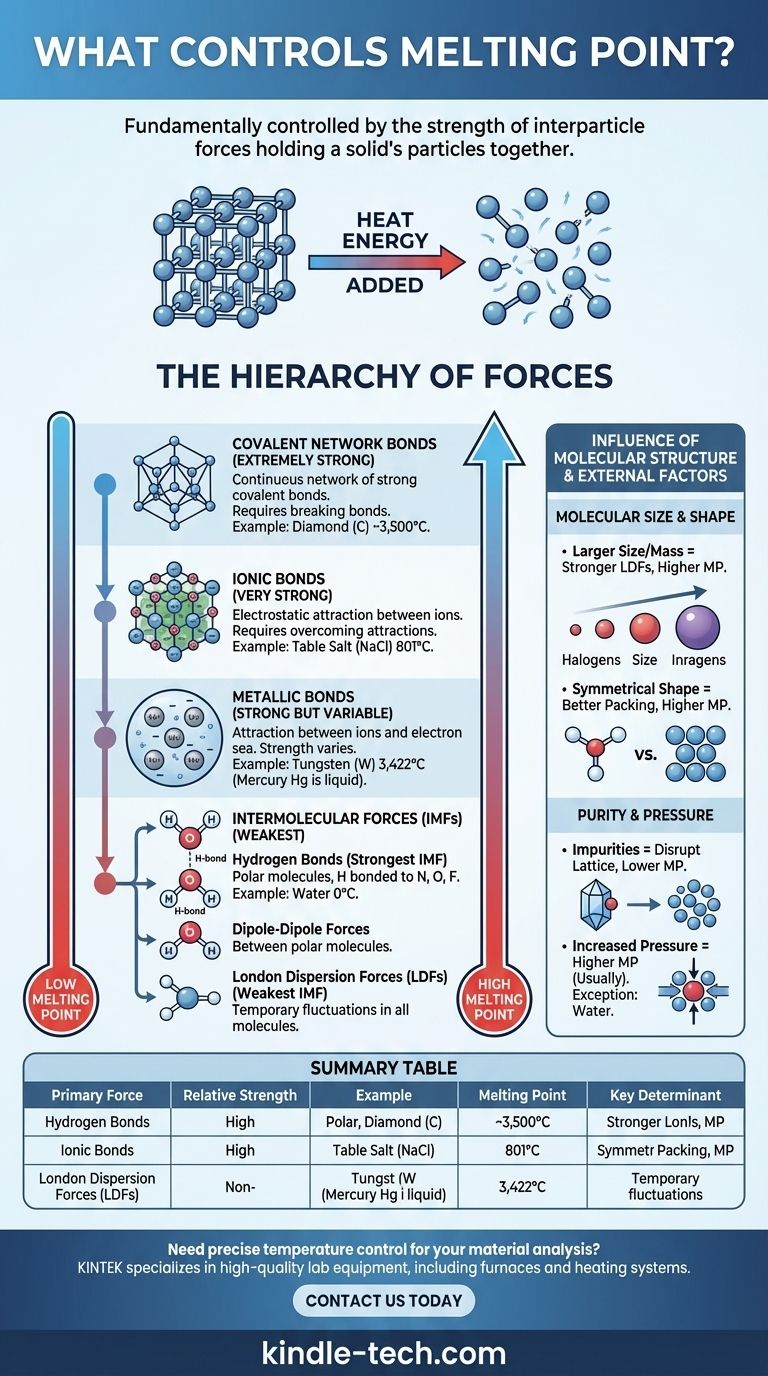
El punto de fusión de una sustancia está fundamentalmente controlado por la fuerza de las fuerzas que mantienen unidas sus partículas. En un sólido, las partículas (átomos, iones o moléculas) están fijas en una disposición ordenada llamada red cristalina. Para fundir el sólido, se debe añadir suficiente energía térmica para permitir que estas partículas superen esas fuerzas y se muevan unas sobre otras como un líquido. Por lo tanto, las fuerzas más fuertes requieren más energía para romperse, lo que resulta en un punto de fusión más alto.
El principio fundamental es simple: la fusión no se trata de romper las partículas en sí mismas, sino de superar las fuerzas atractivas entre ellas. El tipo y la fuerza de estas fuerzas interparticulares —que van desde potentes enlaces iónicos hasta débiles atracciones intermoleculares— son los principales determinantes del punto de fusión de una sustancia.

La jerarquía de fuerzas
La inmensa variación en los puntos de fusión —desde los -259°C del hidrógeno hasta los 3.422°C del tungsteno— puede entenderse clasificando las fuerzas que mantienen unido un sólido. Estas fuerzas existen en una clara jerarquía de fuerza.
Enlaces iónicos (muy fuertes)
En compuestos iónicos como la sal de mesa (NaCl), las partículas son iones cargados positiva y negativamente. Se mantienen unidas por potentes atracciones electrostáticas en una red cristalina rígida.
Superar estos fuertes enlaces iónicos requiere una enorme cantidad de energía térmica. En consecuencia, los compuestos iónicos exhiben consistentemente puntos de fusión muy altos.
Enlaces de red covalente (extremadamente fuertes)
En los sólidos de red covalente, los átomos están unidos por una vasta y continua red de fuertes enlaces covalentes. No existen moléculas individuales; todo el cristal es esencialmente una molécula gigante.
Sustancias como el diamante (carbono) y el cuarzo (dióxido de silicio) son ejemplos claros. Para fundirlos, se deben romper estos enlaces covalentes extremadamente fuertes, lo que exige enormes cantidades de energía, lo que lleva a puntos de fusión excepcionalmente altos.
Enlaces metálicos (fuertes pero variables)
Los metales consisten en una red de iones metálicos positivos inmersos en un "mar" de electrones deslocalizados que se mueven libremente por toda la estructura. La atracción entre los iones positivos y este mar de electrones constituye el enlace metálico.
La fuerza de este enlace, y por lo tanto el punto de fusión, varía ampliamente. Depende de factores como la carga del ion y el número de electrones deslocalizados. Por eso el mercurio es un líquido a temperatura ambiente, mientras que el tungsteno tiene uno de los puntos de fusión más altos de cualquier elemento.
Fuerzas intermoleculares (las más débiles)
Para los compuestos moleculares (como el agua, el azúcar o la cera), las fuerzas que deben superarse para la fusión son las fuerzas intermoleculares (FIM) —las atracciones entre moléculas separadas. Estas son significativamente más débiles que los enlaces iónicos, covalentes o metálicos mencionados anteriormente.
Existen tres tipos principales de FIM:
- Puentes de hidrógeno: El tipo más fuerte de FIM. Ocurre en moléculas polares donde el hidrógeno está unido directamente a un átomo altamente electronegativo (nitrógeno, oxígeno o flúor). El punto de fusión relativamente alto del agua (0°C) se debe a estos fuertes puentes de hidrógeno.
- Fuerzas dipolo-dipolo: Ocurren entre moléculas polares que tienen extremos positivos y negativos permanentes. Estas fuerzas son más débiles que los puentes de hidrógeno.
- Fuerzas de dispersión de London (FDL): La FIM más débil, presente en todas las moléculas. Surgen de fluctuaciones temporales y aleatorias en la distribución de electrones. Aunque individualmente débiles, su efecto acumulativo puede ser significativo en moléculas más grandes.
La influencia de la estructura molecular
Más allá del tipo de fuerza, el tamaño y la forma específicos de las partículas desempeñan un papel crítico, especialmente para los compuestos moleculares.
Tamaño y masa molecular
Para compuestos con la misma fuerza intermolecular primaria (por ejemplo, FDL), las moléculas más grandes tienen puntos de fusión más altos. Esto se debe a que las moléculas más grandes tienen más electrones, creando una nube de electrones más "polarizable" que conduce a fuerzas de dispersión de London más fuertes.
Esta tendencia es clara en los halógenos: el punto de fusión aumenta a medida que se pasa del flúor (F₂) al yodo (I₂).
Forma molecular y eficiencia de empaquetamiento
La capacidad de una molécula para empaquetarse de forma compacta y eficiente en una red cristalina tiene un impacto importante. Las moléculas simétricas a menudo tienen puntos de fusión más altos que los isómeros menos simétricos, incluso si tienen la misma fórmula y masa.
Las formas simétricas permiten que las moléculas encajen más estrechamente en el estado sólido, maximizando la eficacia de sus fuerzas intermoleculares. Romper esta estructura bien organizada requiere más energía.
Entendiendo las compensaciones y los matices
La predicción de los puntos de fusión implica sopesar estos factores interconectados.
La pureza lo cambia todo
Los principios anteriores asumen una sustancia pura. Las impurezas alteran la red cristalina ordenada, debilitando la estructura general.
Esta alteración facilita la fusión del sólido. Como resultado, una sustancia impura se fundirá a una temperatura más baja y en un rango más amplio que su contraparte pura. Este fenómeno se conoce como depresión del punto de fusión.
La presión juega un papel
Los puntos de fusión se suelen indicar a presión atmosférica estándar. Para la mayoría de las sustancias, el aumento de la presión eleva el punto de fusión porque empuja físicamente las partículas más cerca, reforzando la estructura de la red.
El agua es una excepción famosa y crítica. Debido a que el hielo sólido es menos denso que el agua líquida, el aumento de la presión favorece la fase líquida más densa, lo que disminuye el punto de fusión.
Cómo aplicar esto a tu análisis
Al comparar sustancias, utiliza un enfoque sistemático para identificar los factores clave en juego.
- Si tu enfoque principal es comparar diferentes clases de sólidos: Primero, identifica la fuerza de unión primaria: iónica, red covalente, metálica o intermolecular. Esto te dará el indicador más significativo del punto de fusión relativo.
- Si tu enfoque principal es comparar dos compuestos moleculares: Determina la fuerza intermolecular más fuerte que posee cada uno (puentes de hidrógeno > dipolo-dipolo > FDL). El compuesto con la FIM más fuerte generalmente tendrá un punto de fusión más alto.
- Si tu enfoque principal es en moléculas no polares similares: La molécula con mayor masa y área de superficie tendrá fuerzas de dispersión de London más fuertes y, por lo tanto, un punto de fusión más alto.
- Si tu enfoque principal es en isómeros (misma fórmula, diferente forma): La molécula más simétrica que puede empaquetarse de manera más eficiente en una red cristalina a menudo tendrá un punto de fusión más alto.
Al comprender esta jerarquía de fuerzas y la influencia de la estructura, puedes explicar sistemáticamente el comportamiento de fusión de casi cualquier sustancia.
Tabla resumen:
| Tipo de fuerza primaria | Fuerza relativa | Sustancia de ejemplo | Punto de fusión | Determinante clave |
|---|---|---|---|---|
| Red covalente | Extremadamente fuerte | Diamante (C) | ~3.500°C | Ruptura de enlaces covalentes en una red continua |
| Enlaces iónicos | Muy fuerte | Cloruro de sodio (NaCl) | 801°C | Superación de atracciones electrostáticas entre iones |
| Enlaces metálicos | Fuerte (variable) | Tungsteno (W) | 3.422°C | Fuerza de la atracción ion-mar de electrones |
| Fuerzas intermoleculares | Las más débiles | Agua (H₂O) | 0°C | Puentes de hidrógeno, dipolo-dipolo, fuerzas de dispersión de London |
¿Necesitas un control preciso de la temperatura para tu análisis de materiales? Comprender los puntos de fusión es fundamental para obtener resultados de laboratorio fiables. En KINTEK, nos especializamos en equipos de laboratorio de alta calidad, incluyendo hornos y sistemas de calefacción diseñados para un análisis térmico preciso. Ya sea que trabajes con metales de alto punto de fusión o compuestos moleculares sensibles, nuestras soluciones garantizan un rendimiento constante. Contáctanos hoy mismo para discutir cómo nuestros productos pueden mejorar las capacidades de tu laboratorio y apoyar tu investigación. ¡Comunícate a través de nuestro formulario de contacto para empezar!
Guía Visual
Productos relacionados
- Horno de Mufla de Laboratorio con Elevación Inferior
- Horno de mufla de 1800℃ para laboratorio
- Horno de mufla de 1400 ℃ para laboratorio
- Horno de mufla de 1700℃ para laboratorio
- Horno de Tubo de Laboratorio de Alta Temperatura de 1400℃ con Tubo de Alúmina
La gente también pregunta
- ¿Cómo afecta el calor a la resistencia de los materiales? Comprensión de la degradación térmica y la falla por fluencia (creep)
- ¿Cuál es el nombre del horno industrial? Una guía para clasificar equipos de calefacción
- ¿Bajo qué condiciones se requiere el proceso de recocido? Restaurar la ductilidad y aliviar la tensión
- ¿Qué industrias utilizan la soldadura? El proceso esencial que impulsa la electrónica moderna
- ¿Cómo se almacenan típicamente las muestras biológicas en congeladores ULT? Una guía para la organización sistemática
- ¿Cuál es una alternativa al evaporador rotatorio? Encuentre la tecnología de evaporación adecuada para su laboratorio
- ¿Cuáles son las desventajas del horno de arco eléctrico? Altos costos, demanda de energía y desafíos operativos
- ¿Aumenta la resistencia a la tracción con el tratamiento térmico? Cómo diseñar las propiedades metálicas perfectas



















