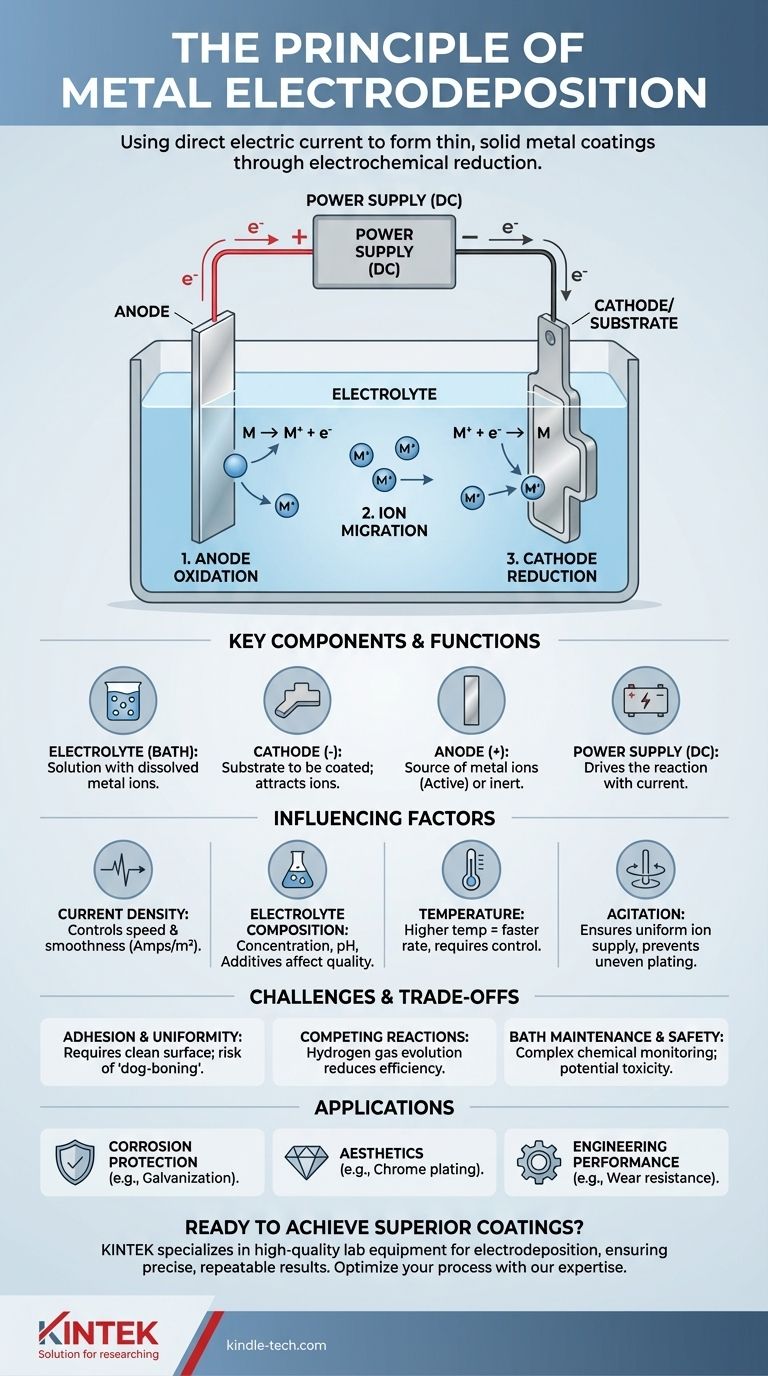
En esencia, el principio de la electrodeposición es el proceso de usar una corriente eléctrica directa para reducir iones metálicos disueltos de una solución y formar una capa delgada y sólida de metal sobre un objeto conductor. Esta reacción electroquímica controlada le permite "platear" un metal sobre otro, alterando fundamentalmente las propiedades superficiales del material base.
Todo el proceso depende de la creación de un circuito electrolítico. En este circuito, la electricidad impulsa una reacción química no espontánea, forzando a los iones metálicos con carga positiva en un baño líquido a aceptar electrones y depositarse como una capa de metal neutro sobre una superficie objetivo.
Los componentes centrales de un sistema de electrodeposición
Para comprender el principio en la práctica, primero debe comprender sus cuatro componentes esenciales que trabajan juntos dentro de una celda electrolítica.
El electrolito (El baño)
El electrolito es una solución que contiene una alta concentración de los iones metálicos que desea depositar. Esto se logra típicamente disolviendo sales metálicas (como sulfato de cobre o cloruro de níquel) en agua. El baño también contiene otros aditivos para controlar la calidad del recubrimiento final.
El cátodo (El sustrato)
El cátodo es el objeto que se pretende recubrir. Está conectado al terminal negativo de la fuente de alimentación. Esta carga negativa atrae los iones metálicos con carga positiva del electrolito.
El ánodo (La fuente de metal)
El ánodo está conectado al terminal positivo de la fuente de alimentación. Puede ser de uno de dos tipos:
- Ánodo activo: Hecho del mismo metal que se está plateando. Se disuelve lentamente, reponiendo los iones metálicos en el electrolito a medida que se depositan en el cátodo.
- Ánodo inerte: Hecho de un material no reactivo (como platino o carbono). No se disuelve, pero sirve para completar el circuito eléctrico. En este caso, los iones metálicos en el baño se agotan con el tiempo.
La fuente de alimentación
Una fuente de alimentación de corriente continua (CC) actúa como el motor de todo el proceso. Proporciona el potencial eléctrico necesario para impulsar los electrones hacia el cátodo y extraerlos del ánodo, forzando a que ocurra la reacción de deposición.
El proceso electroquímico, paso a paso
El proceso de deposición es un ciclo continuo de oxidación y reducción impulsado por la fuente de alimentación externa.
Paso 1: Oxidación en el ánodo
En el ánodo positivo, ocurre una reacción de oxidación. Si el ánodo es activo, sus átomos metálicos pierden electrones y se convierten en iones con carga positiva, disolviéndose en el electrolito. Esto mantiene constante el suministro de iones metálicos.
Paso 2: Migración de iones en el electrolito
Los iones metálicos con carga positiva (cationes) presentes en el electrolito son atraídos a través de la solución hacia el cátodo con carga negativa. Simultáneamente, los iones negativos (aniones) se desplazan hacia el ánodo positivo, manteniendo la solución eléctricamente neutra.
Paso 3: Reducción en el cátodo
Este es el paso de deposición. Cuando los iones metálicos llegan al cátodo, ganan electrones suministrados por la fuente de alimentación. Esta reacción de reducción neutraliza su carga, haciendo que precipiten fuera de la solución y se unan a la superficie como átomos de metal sólido, construyendo la capa de recubrimiento capa por capa.
Factores clave que influyen en la calidad de la deposición
La calidad, el grosor y la apariencia del recubrimiento final no son automáticos. Dependen del control cuidadoso de varias variables clave.
Densidad de corriente
Es la cantidad de corriente por unidad de área superficial del cátodo (medida en amperios/m²).
- Una baja densidad de corriente da como resultado un recubrimiento lento pero a menudo más suave y uniforme.
- Una alta densidad de corriente acelera la deposición, pero puede provocar depósitos ásperos, porosos o quemados si no se gestiona correctamente.
Composición del electrolito
La concentración de iones metálicos, el nivel de pH y la presencia de aditivos (como abrillantadores y niveladores) tienen un gran impacto. Estos aditivos pueden alterar la estructura cristalina del metal que se deposita, cambiando su acabado de opaco a brillante como un espejo.
Temperatura
Las temperaturas más altas del baño generalmente aumentan la conductividad del electrolito y la velocidad de deposición. Sin embargo, las temperaturas excesivamente altas pueden causar reacciones secundarias no deseadas o la descomposición de los aditivos.
Agitación
Remover o agitar el baño es fundamental. Asegura que un suministro fresco de iones metálicos llegue a la superficie del cátodo, previniendo el agotamiento localizado que causa un plateado desigual, especialmente en formas complejas.
Comprender las compensaciones y los desafíos
Aunque es potente, la electrodeposición es un proceso preciso con puntos de fallo comunes.
Adhesión y uniformidad del recubrimiento
El factor más crítico para el éxito es la preparación del sustrato. Una superficie sucia u oxidada resultará en una mala adhesión, haciendo que el recubrimiento se pele o se desprenda. Además, la corriente eléctrica se concentra naturalmente en los bordes y esquinas afiladas, lo que provoca depósitos más gruesos allí y depósitos más delgados en los huecos, un problema conocido como el efecto "dog-boning" (efecto de hueso de perro).
Reacciones competidoras
La principal reacción competidora, especialmente en electrolitos acuosos, es la reducción del agua para producir gas hidrógeno en el cátodo. Este proceso consume corriente eléctrica que de otro modo se utilizaría para la deposición de metales, reduciendo la eficiencia general. En algunos casos, el hidrógeno absorbido también puede hacer que el sustrato se vuelva quebradizo.
Mantenimiento del baño y seguridad
Los baños de electrodeposición son sistemas químicos complejos que requieren un monitoreo y ajuste constantes del pH, la temperatura y las concentraciones químicas. Muchas soluciones de plateado industrial, como las que contienen cianuro o cromo hexavalente, son altamente tóxicas y representan riesgos significativos para el medio ambiente y la seguridad del operador.
Tomar la decisión correcta para su aplicación
Comprender el principio central le permite adaptar el proceso a su objetivo específico.
- Si su enfoque principal es la protección contra la corrosión: Su objetivo es una capa densa y no porosa, a menudo utilizando un metal de sacrificio como el zinc sobre acero (galvanización) o un metal noble como el oro.
- Si su enfoque principal es la estética: Debe controlar cuidadosamente la densidad de corriente y utilizar aditivos específicos como abrillantadores para lograr una superficie lisa y reflectante, como se ve con el plateado de cromo o níquel.
- Si su enfoque principal es el rendimiento de ingeniería (p. ej., resistencia al desgaste): Necesita un control preciso del grosor y la dureza, a menudo logrado con recubrimientos de cromo duro o níquel químico, donde la fuerte adhesión es primordial.
Al controlar el flujo de iones y electrones, puede transformar la superficie de un material para satisfacer una necesidad estética o de ingeniería específica.

Tabla de resumen:
| Componente clave | Función en la electrodeposición |
|---|---|
| Electrolito (Baño) | Solución que contiene iones metálicos disueltos a depositar. |
| Cátodo (Sustrato) | El objeto a recubrir; atrae iones metálicos positivos. |
| Ánodo (Fuente de metal) | Fuente de iones metálicos (activo) o electrodo inerte. |
| Fuente de alimentación (CC) | Suministra la corriente para impulsar la reacción no espontánea. |
| Densidad de corriente | Controla la velocidad de deposición y la calidad del recubrimiento (suavidad). |
| Aditivos del baño | Influyen en las propiedades finales del recubrimiento (p. ej., brillo, dureza). |
¿Listo para lograr recubrimientos metálicos superiores en su laboratorio?
Comprender los principios de la electrodeposición es el primer paso. Implementarlo de manera efectiva requiere el equipo y los consumibles adecuados. KINTEK se especializa en equipos de laboratorio de alta calidad para electrodeposición y otros procesos de ingeniería de superficies, ayudándole a lograr resultados precisos, confiables y repetibles.
Ya sea que se centre en la investigación, el control de calidad o el desarrollo de nuevos recubrimientos, nuestra experiencia puede respaldar las necesidades de su laboratorio.
¡Póngase en contacto con nuestros expertos hoy mismo para analizar cómo podemos ayudarle a optimizar su proceso de electrodeposición!
Guía Visual
Productos relacionados
- Crisol de cobre libre de oxígeno para recubrimiento por evaporación de haz de electrones y bote de evaporación
- Equipo de sistema de horno de tubo CVD versátil hecho a medida para deposición química de vapor
- Máquina de montaje de especímenes metalúrgicos para materiales y análisis de laboratorio
- Máquina Prensadora Eléctrica de Tabletas de un Solo Punzón Prensa TDP para Polvo de Laboratorio
- Celdas personalizables de electrólisis PEM para diversas aplicaciones de investigación
La gente también pregunta
- ¿Cómo se llama el recipiente que contiene el material fuente metálico en la evaporación por haz de electrones? Asegure la pureza y calidad en su deposición de película delgada
- ¿Qué es el recubrimiento por haz de electrones? Una guía para películas delgadas PVD de alto rendimiento
- ¿Cuáles son los dos métodos que se pueden utilizar para prevenir la corrosión de un metal? Explicación de la protección de barrera frente a la protección de sacrificio.
- ¿Qué es la pulverización catódica de oro? Una guía para el recubrimiento al vacío de alta pureza para electrónica y SEM
- ¿Qué tan grueso es el recubrimiento por pulverización catódica para SEM? Logre una imagen y un análisis óptimos



















