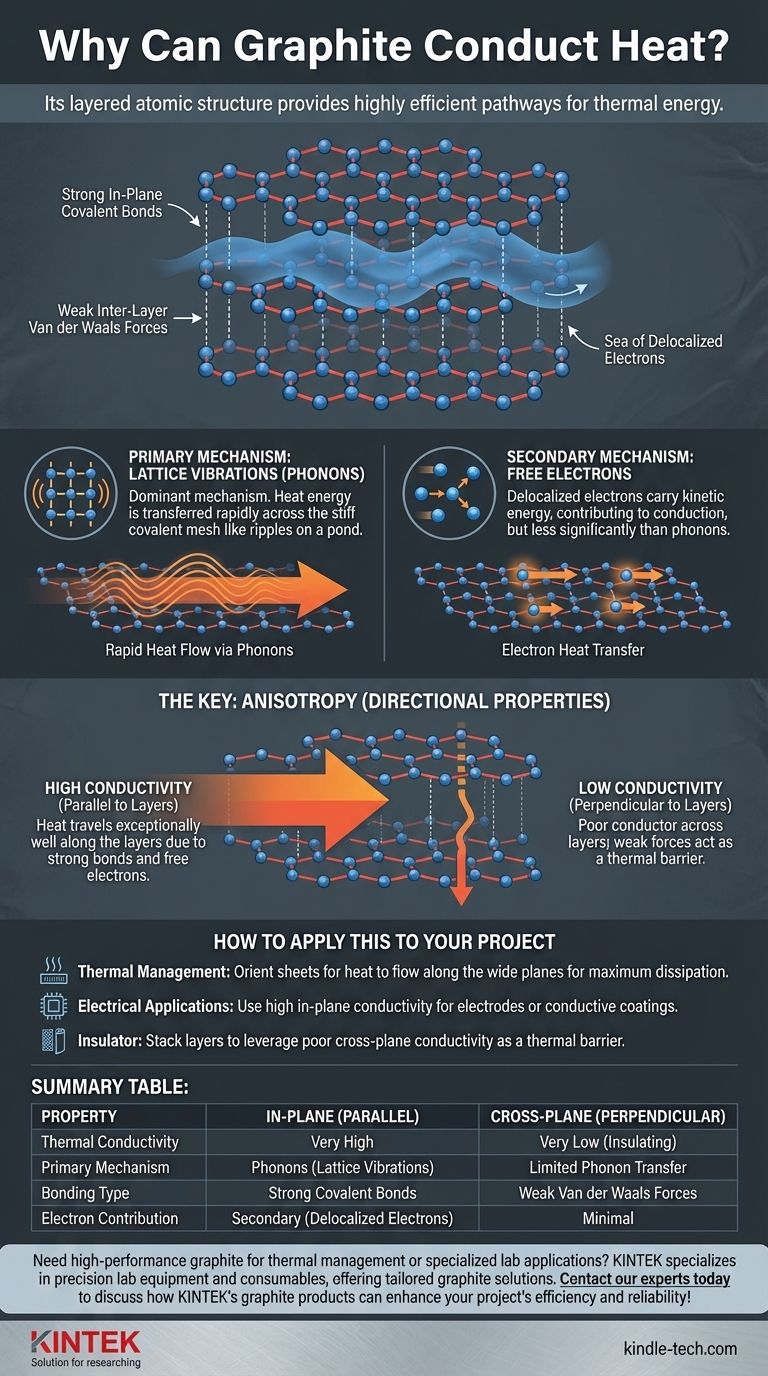
En esencia, el grafito conduce el calor porque su estructura atómica única y en capas proporciona vías altamente eficientes para que la energía térmica viaje. Esto ocurre principalmente a través de vibraciones atómicas sincronizadas, con una contribución secundaria de los mismos electrones libres que le permiten conducir la electricidad.
La excelente conductividad térmica del grafito no se debe solo a los electrones libres; está dominada por la transferencia eficiente de vibraciones de la red (fonones) a través de sus capas de carbono fuertes y fuertemente unidas. Esta estructura dicta cómo y dónde puede fluir el calor.

La Estructura Única del Grafito
Para entender por qué el grafito es un conductor térmico eficaz, primero debemos examinar su disposición atómica. Es un alótropo del carbono, lo que significa que sus propiedades se definen enteramente por su estructura.
Capas de Átomos de Carbono
El grafito consiste en vastas láminas bidimensionales de átomos de carbono. Cada lámina, conocida como capa de grafeno, está dispuesta en una red hexagonal tipo panal.
Fuertes Enlaces Dentro del Plano
Dentro de cada capa, cada átomo de carbono está unido a otros tres por enlaces covalentes extremadamente fuertes. Estos enlaces son rígidos y crean un plano rígido y estable.
Enlaces Intercapa Débiles
Estas capas planas de grafeno están apiladas una encima de la otra. Sin embargo, están unidas solo por fuerzas intermoleculares débiles conocidas como fuerzas de van der Waals, lo que facilita que las capas se deslicen entre sí.
Un "Mar" de Electrones Deslocalizados
La unión dentro de las capas solo utiliza tres de los cuatro electrones externos del carbono. El cuarto electrón de cada átomo está deslocalizado, formando un "mar" de electrones móviles que pueden moverse libremente a lo largo del plano de la capa, pero no fácilmente entre capas.
Los Dos Mecanismos de Transferencia de Calor
El calor en un sólido es simplemente la energía cinética de sus átomos vibrantes. La transferencia de esta energía ocurre a través de dos mecanismos principales en el grafito, ambos dictados por su estructura.
Impulsor Primario: Vibraciones de la Red (Fonones)
El mecanismo dominante para la transferencia de calor en el grafito es a través de fonones, que son paquetes cuantizados de energía vibracional.
Piense en los fuertes enlaces covalentes dentro de una capa de grafeno como una malla rígida y tensa. Cuando una parte de la capa se calienta y vibra, la energía se transfiere rápidamente a través de toda la malla, de manera similar a como las ondas se propagan por la superficie de un estanque.
Contribuyente Secundario: Electrones Libres
Los electrones deslocalizados que hacen del grafito un excelente conductor eléctrico también desempeñan un papel en la conducción térmica. Estos electrones móviles transportan energía cinética y la transfieren a medida que se mueven a través de la red.
Sin embargo, en el grafito, su contribución a la conductividad térmica general es significativamente menor que la de los fonones.
Comprendiendo la Compensación Clave: Anisotropía
La consecuencia más importante de la estructura en capas del grafito es que sus propiedades no son las mismas en todas las direcciones. Esto se conoce como anisotropía.
Alta Conductividad a lo Largo de las Capas
El calor viaja excepcionalmente bien paralelo a las capas de grafeno. Los fuertes enlaces proporcionan un camino perfecto e ininterrumpido para los fonones, y los electrones deslocalizados se mueven libremente dentro de este plano.
Baja Conductividad Entre las Capas
Por el contrario, el grafito es un mal conductor térmico (un aislante) en la dirección perpendicular a las capas. Las débiles fuerzas de van der Waals son ineficientes para transmitir vibraciones de una capa a la siguiente, creando una barrera térmica.
Cómo Aplicar Esto a Su Proyecto
Comprender esta propiedad direccional es fundamental para usar el grafito de manera efectiva en cualquier aplicación.
- Si su enfoque principal es la gestión térmica: Debe orientar las láminas de grafito para que la fuente de calor se conduzca a lo largo de los planos anchos y planos para lograr la máxima disipación.
- Si su enfoque principal son las aplicaciones eléctricas: La alta conductividad en el plano lo hace ideal para electrodos o recubrimientos conductores donde la corriente necesita fluir a través de una superficie.
- Si su enfoque principal es usarlo como aislante: Puede aprovechar la baja conductividad entre planos apilando capas para crear una barrera térmica en una dirección específica.
En última instancia, el comportamiento térmico del grafito es una clase magistral de cómo la estructura atómica de un material gobierna directamente su función en el mundo real.
Tabla Resumen:
| Propiedad | En el Plano (Paralelo a las Capas) | Entre Planos (Perpendicular a las Capas) |
|---|---|---|
| Conductividad Térmica | Muy Alta | Muy Baja (Aislante) |
| Mecanismo Primario | Fonones (Vibraciones de la Red) | Transferencia Limitada de Fonones |
| Tipo de Enlace | Fuertes Enlaces Covalentes | Débiles Fuerzas de Van der Waals |
| Contribución Electrónica | Secundaria (Electrones Deslocalizados) | Mínima |
¿Necesita grafito de alto rendimiento para gestión térmica o aplicaciones de laboratorio especializadas? KINTEK se especializa en equipos de laboratorio de precisión y consumibles, ofreciendo soluciones de grafito personalizadas que aprovechan sus propiedades anisotrópicas únicas. Ya sea que requiera una conductividad superior en el plano para la disipación de calor o un aislamiento controlado, nuestra experiencia garantiza un rendimiento óptimo del material para las necesidades de su laboratorio. Contacte a nuestros expertos hoy para discutir cómo los productos de grafito de KINTEK pueden mejorar la eficiencia y confiabilidad de su proyecto.
Guía Visual
Productos relacionados
- Horno Vertical de Vacío de Grafito de Alta Temperatura para Grafización
- Horno de grafización al vacío a ultra alta temperatura de grafito
- Horno Continuo de Grafización al Vacío de Grafito
- Horno de Grafización de Película de Alta Conductividad Térmica de Vacío de Grafito
- Horno de Tubo de Laboratorio de Alta Temperatura de 1400℃ con Tubo de Alúmina
La gente también pregunta
- ¿Cuáles son las propiedades físicas y químicas del grafito? Un material único para aplicaciones extremas
- ¿El grafito se ve afectado por el calor? Descubra su notable resistencia y estabilidad a altas temperaturas
- ¿Para qué se utiliza el horno de grafito? Lograr calor extremo de hasta 3000 °C en un entorno controlado
- ¿A qué temperatura se funde el grafito? Comprendiendo su cambio de fase extremo
- ¿Por qué el grafito no se derrite? Descubriendo los secretos de su extrema resistencia al calor



















